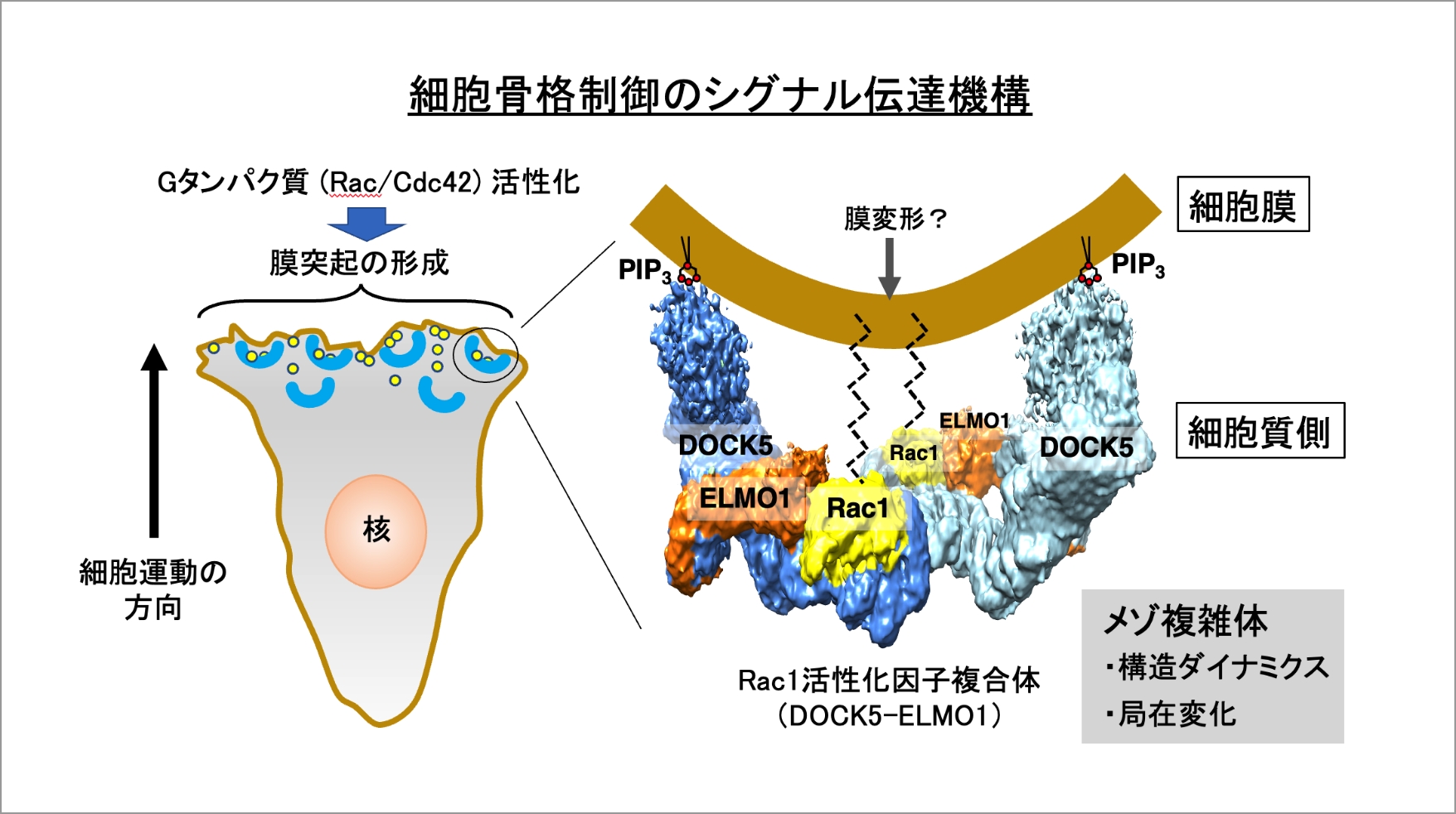
細胞骨格制御シグナル伝達における細胞内分子構造動態の解析

柊元(新野) 睦子(研究代表者)
国立研究開発法人理化学研究所 生命機能科学研究センター 上級技師
計画研究の概要
細胞の運動は、免疫応答や神経血管形成など生体内で重要な役割を果たすとともに、がんの浸潤や転移などの疾患にも関連しています。Gタンパク質のグアニンヌクレオチド交換因子であるDOCK (Dedicator of cytokinesis protein) は、アクチン細胞骨格を制御するシグナル伝達に重要なGタンパク質RacやCdc42を活性化し、細胞の形態変化やがん細胞の運動を促進します。そのため、DOCKはがん治療薬の新たな標的として認識されています。最近、私たちのグループは、DOCKシグナル伝達因子複合体の様々な活性化状態における動的構造を、クライオ電子顕微鏡を用いて捉えることに成功しました。しかし、DOCKとGタンパク質が形成するメゾ複雑体の、細胞膜近傍での構造ダイナミクスについては、まだ分かっていません。そこで本研究では、アクチン細胞骨格形成の時空間制御因子であるDOCKとGタンパク質の細胞内環境における分子構造動態を、クライオ電子顕微鏡単粒子解析とクロススケール計測技術によって明らかにします。本研究の成果は、膜の形状変化やGタンパク質の局在制御など、DOCKが関与する新たな細胞内現象の解明につながると期待されます。
主な研究業績
- Kukimoto-Niino M., Katsura K., Kaushik R., Ehara H., Yokoyama T., Uchikubo-Kamo T., Nakagawa R., Mishima-Tsumagari C., Yonemochi M., Ikeda M., Hanada K., Zhang K.Y.J., Shirouzu M. Cryo-EM structure of the human ELMO1-DOCK5-Rac1 complex. Sci. Adv., 7(30), eabg3147 (2021).
- Kasahara K., Re S., Nawrocki G., Oshima H., Mishima-Tsumagari C., Miyata-Yabuki Y., Kukimoto-Niino M., Yu I., Shirouzu M., Feig M., Sugita Y. Reduced efficacy of a Src kinase inhibitor in crowded protein solution. Nat. Commun., 12(1), 4099 (2021).
- Sakurai T., Kukimoto-Niino M., Kunimura K., Yamane N., Sakata D., Aihara R., Yasuda T., Yokoyama S., Shirouzu M., Fukui Y., Uruno T. A conserved PI(4,5)P2-binding domain is critical for immune regulatory function of DOCK8. Life Sci. Alliance, 4(4), e202000873 (2021).
- Kukimoto-Niino M., Tsuda K., Ihara K., Mishima-Tsumagari C., Honda K., Ohsawa N., Shirouzu M. Structural Basis for the Dual Substrate Specificity of DOCK7 Guanine Nucleotide Exchange Factor. Structure, 27(5):741-748.e3 (2019).
- Sakurai T., Uruno T., Sugiura Y., Tatsuguchi T., Yamamura K., Ushijima M., Hattori Y., Kukimoto-Niino M., Mishima-Tsumagari C., Watanabe M., Suematsu M., Fukui Y. Cholesterol sulfate is a DOCK2 inhibitor that mediates tissue-specific immune evasion in the eye. Sci. Signal., 11(541), eaao4874 (2018).
- Tajiri H., Uruno T., Shirai T., Takaya D., Matsunaga S., Setoyama D., Watanabe M., Kukimoto-Niino M., Oisaki K., Ushijima M., Sanematsu F., Honma T., Terada T., Oki E., Shirasawa S., Maehara Y., Kang D., Côté J.F., Yokoyama S., Kanai M., Fukui Y. Targeting Ras-Driven Cancer Cell Survival and Invasion through Selective Inhibition of DOCK1. Cell Rep., 19(5), 969-980 (2017).
- Hanawa-Suetsugu K., Kukimoto-Niino M., Mishima-Tsumagari C., Akasaka R., Ohsawa N., Sekine S., Ito T., Tochio N., Koshiba S., Kigawa T., Terada T., Shirouzu M., Nishikimi A., Uruno T., Katakai T., Kinashi T., Kohda D., Fukui Y., Yokoyama S. Structural basis for mutual relief of the Rac guanine nucleotide exchange factor DOCK2 and its partner ELMO1 from their autoinhibited forms. Proc. Natl. Acad. Sci. U. S. A., 109(9), 3305-3310 (2012).