メゾ複雑体ユビキチン液滴が司るタンパク質分解

計画研究の概要
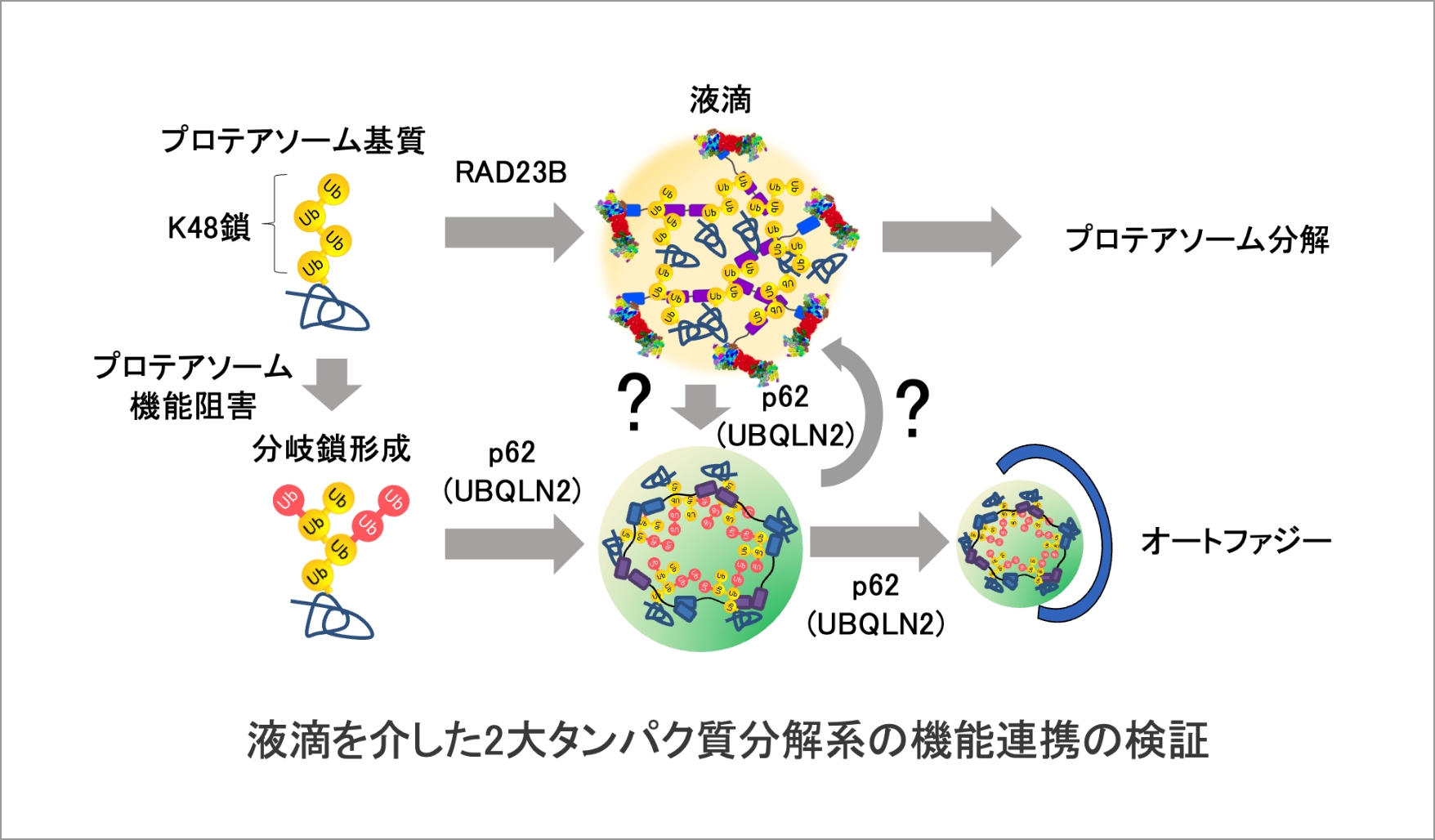
ユビキチン・プロテアソーム系は異常タンパク質や役目を終えたタンパク質を選択的に分解することによりタンパク質恒常性の維持に必須の役割を果たしている。最近、我々は、プロテアソームが様々なストレスに応答してユビキチン化基質と液-液相分離(LLPS)し、核や細胞質にメゾスケールの液滴を形成することを見出した。これらプロテアソーム液滴の形成は、特定のユビキチン鎖と専用のユビキチンデコーダーRAD23Bの多価相互作用が駆動力となる。一方、ユビキチン選択的オートファジーやストレス顆粒においてもp62やUBQLN2などのユビキチンデコーダーがキー分子となりユビキチンを含有する液滴様構造体を形成することがわかってきた。これらユビキチン液滴の制御分子はいずれも神経変性疾患の関連因子であるため、ユビキチン陽性凝集体の形成にも関与する可能性が示唆されている。しかしながら、液滴形成を誘導するユビキチンコード、そしてそれらの凝集体形成(液-固相転移)への関与は依然として不明である。そこで本課題では、ユビキチン液滴の再構築系を開発するとともに、易凝集性基質をモデルとした相転移仮説の検証、さらに、メゾ複雑体としてのユビキチン液滴を介したプロテアソームとオートファジーの連携機構を解明する。
主な研究業績
- Yasuda S, *Tsuchiya H, *Kaiho A, Guo Q, Ikeuchi K, Endo A, Arai N, Ohtake F, Murata S, Inada T, Baumeister W, Fernandez-Busnadiego R, Tanaka K, Saeki Y. Stress- and ubiquitylation-dependent phase separation of the proteasome. Nature 578, 296-300, 2020 (* co-1st authors)
- *Sato Y, *Tsuchiya H, Yamagata A, Okatsu K, Tanaka, K, Saeki Y, Fukai S. Structural insights into ubiquitin recognition and Ufd1 interaction of Npl4. Nat. Commun. 10, 5709 (2019)(* co-1st authors)
- Tsuchiya, H., Burana, D., Ohtake, F., Arai, N., Kaiho, A., Komada, M., Tanaka, K., and Saeki, Y. Ub-ProT reveals global length and composition of protein ubiquitylation in cells. Nat. Commun. 9, 524 (2018)
- Tsuchiya, H., Ohtake, F., Arai, N., Yasuda, S., Tanaka, K., and Saeki, Y. In Vivo Ubiquitin Linkage-type Analysis Reveals that the Cdc48-Rad23/Dsk2 Axis Contributes to K48-Linked Chain Specificity of the Proteasome. Mol. Cell 66, 488-502 (2017)