クロススケール核膜孔内選択的分子輸送システムの解明とその破綻

計画研究の概要
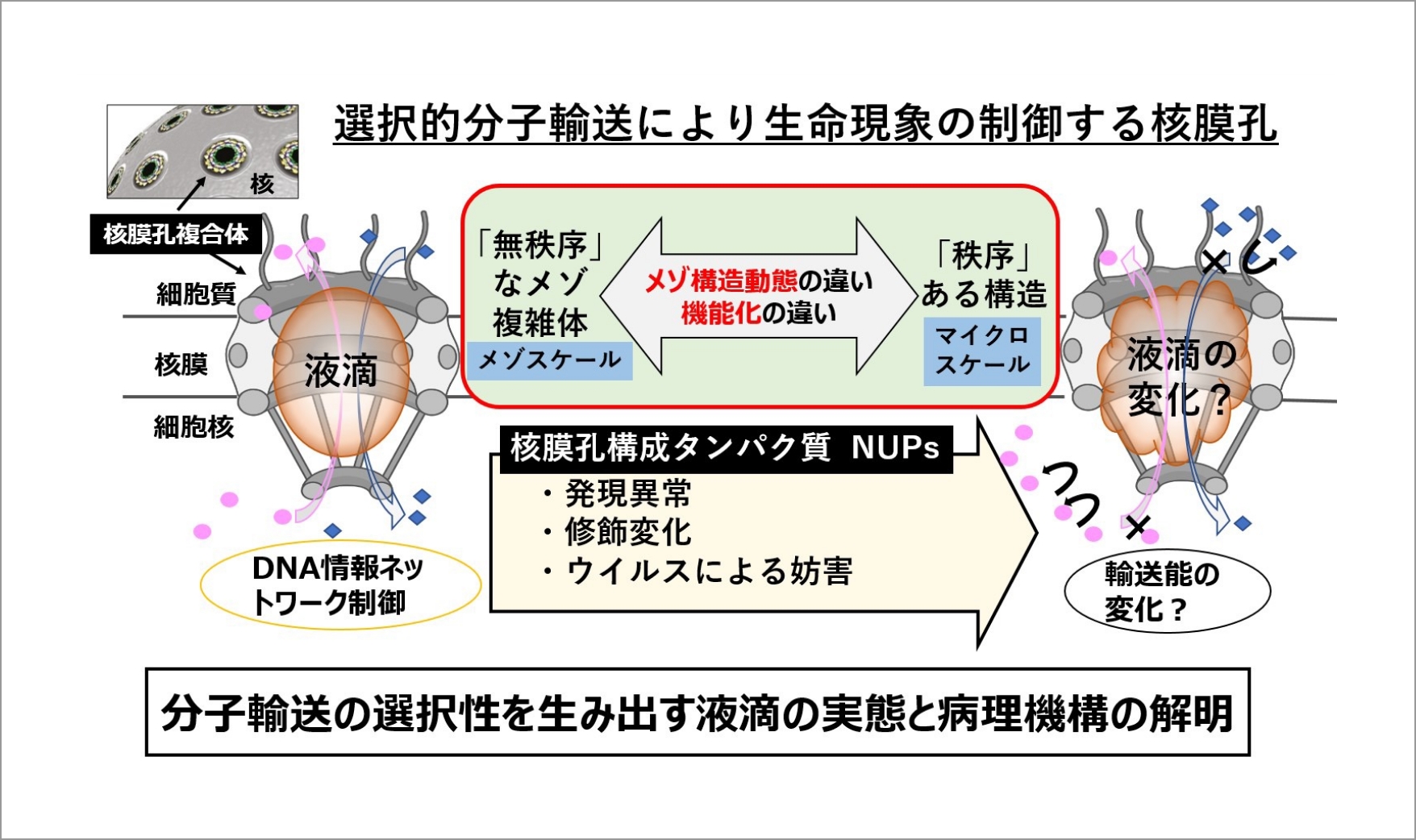
近年、生体分子が集まることで「液滴」を形成する現象(相分離)は、細胞の生理機能の原動力であることが判明し、生命反応の作動原理を解き明かす重要なパラダイムとして注目されている。核-細胞質を結ぶ唯一の「メゾ複雑体」輸送孔である核膜孔は、その内部に相分離から成る液滴を形成し、細胞増殖やウイルス感染応答にともなうすべてのDNA情報ネットワークを選択的に制御する。申請者らは、核膜孔を構成するタンパク質の発現異常により、核-細胞質間分子輸送が破綻し、がん悪性化や免疫応答異常に繋がることを明らかにしてきた。病態で変化する分子輸送の仕組みを理解するには、核膜孔内部の液滴の状態と機能相関のクロススケール核膜孔内分子構造動態の解明が必要である。しかし、相分離を調べるための技術整備は途上であり、核膜孔による選択的分子輸送の基盤となる相分離の実態は不明である。申請者らは、ごく最近、高速原子間力顕微鏡(高速AFM)を用いたナノイメージング技術により、 核膜孔内部の液滴の可視化に世界で初めて成功した。さらに、細胞内の液滴の物性を評価できる蛍光プローブを開発した。
本研究では、申請者らが確立してきた独自のイメージング技術により、選択的核膜分子輸送システムの基盤となる相分離のメゾ動態と機能化メカニズムを解明する。核膜孔が形成する相分離の根本的な理解により、生命現象の基盤である核膜物質輸送機序の解明は勿論、発がん機序解明やウイルス感染応答に対する理解が深化し、相分離を指標とした細胞診断や治療法開発への発展が期待される。
主な研究業績
- Lim K., Nishide G., Yoshida T., Watanabe-Nakayama T., Kobayashi A., Hazawa M., Hanayama R., Ando T., and Wong R.W. Millisecond dynamic of SARS-CoV-2 spike and its interaction with ACE2 receptor and small extracellular vesicles. Journal of Extracellular Vesicles, 10, e12170 (2021).
- Dewi, F.R.P., Jiapaer S., Kobayashi A., Hazawa M., Ikliptikawati D.K., Hartono, Sabit H., Nakada M., and Wong R.W. Nucleoporin TPR (translocated promoter region, nuclear basket protein) upregulation alters MTOR-HSF1 trails and suppresses autophagy induction in ependymoma. Autophagy, 17,1001-1012 (2021).
- Lim K., Kodera N., Wang H., Mohamed M., Hazawa M., Kobayashi A., Yoshida T., Hanayama R., Yano S., Ando T., and Wong R.W. High-speed AFM reveals molecular dynamic of human influenza A hemagglutinin and its interaction with exosomes. Nano Letters, 20, 6320–6328 (2020).
- Mohamed M.S., Hazawa M., Kobayashi A., Guillaud L., Watanabe-Nakayama T., Nakayama M., Wang H., Kodera N., Oshima M., Ando T., and Wong R.W. Spatiotemporally tracking of nano-biofilaments inside the nuclear pore complex core Biomaterials, 256,120198 (2020).
- Mohamed M.S., Kobayashi A., Taoka A., Watanabe-Nakayama T., Kikuchi Y., Hazawa M., Minamoto T., Fukumori Y., Kodera N., Uchihashi T., Ando T., and Wong R.W. High-Speed Atomic Force Microscopy Reveals Loss of Nuclear Pore Resilience as a Dying Code in Colorectal Cancer Cells. ACS Nano, 11, 5567-5578 (2017).