局所光操作と蛍光寿命イメージングによるシナプス内メゾスケール組織化機構の解明

計画研究の概要
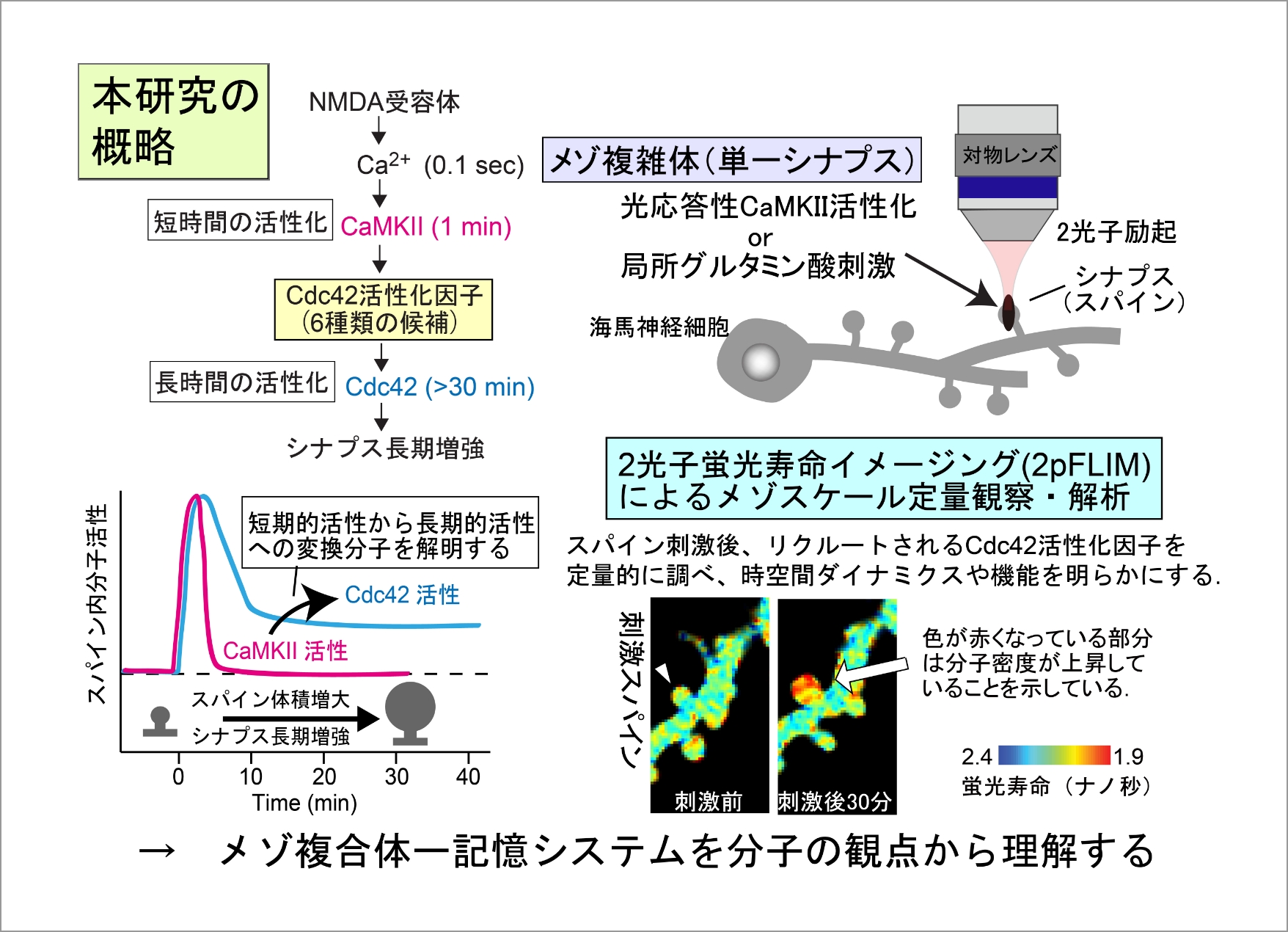
神経回路の形成と機能の基礎となるシナプスは数万タンパク質分子からなる300ナノメートル程度のメゾ複雑体である。その形態・体積や内部構造は動的に制御されており、動物の記憶メカニズムの基礎と考えられている。これまで申請者らは、2光子蛍光寿命イメージング顕微鏡法により、海馬興奮性シナプスにおいて、短時間のCa2+流入およびCaMKII活性化が局所的かつ動的な長時間の低分子量Gタンパク質(Cdc42)活性に変換されることがシナプス長期増強の基礎となっていることを明らかにした。しかしながら、このタイムスケール変換メカニズムは分かっておらずシナプス研究の重要な課題となっている。Cdc42の長時間活性化(メモリー分子)は長期間の記憶の維持と直接関係している可能性があることから生物学的に極めて重要である。本研究では、Cdc42の活性化因子(脳の遺伝疾患関連因子を含む)に着目し、網羅的にそれらのダイナミクスと分子機能を2光子蛍光寿命イメージング顕微鏡法と局所分子光操作法により明らかにする。このようにして、メゾ複雑体であるシナプスにおいて、短時間シグナルを長期持続シグナルに変換するメカニズムを分子集合・離散の観点から明らかにし、記憶システムや脳の遺伝疾患メカニズムの解明につなげたい。
主な研究業績
- Ueda HH, Nagasawa Y, Sato A, Onda M, and Murakoshi H* Chronic neuronal excitation leads to dual metaplasticity in the signaling for structural long-term potentiation. Cell Reports, 38, 110153 (2022).
- Shibata AC, Ueda HH, Eto K, Onda M, Sato A, Ohba T, Nabekura J, and Murakoshi H* Photoactivatable CaMKII induces synaptic plasticity in single synapses. Nature communications 12, 751 (2021).
- Murakoshi H*, Shin M, Parra-Bueno P, Szatmari EM, Shibata AC, and Yasuda R. Kinetics of endogenous CaMKII required for synaptic plasticity revealed by optogenetic kinase inhibitor. Neuron 94, 37-47 (2017).
- Hedrick NG, Harward SC, Hall CE, Murakoshi H, McNamara JO, and Yasuda R. Rho GTPase complementation underlies BDNF-dependent homo- and heterosynaptic plasticity. Nature 538, 104-108 (2016).