西田紀貴計画研究代表の杉田有治計画研究代表の領域内共同研究成果がJ. Am. Chem. Soc.誌に掲載されました
- Deciphering the multi-state conformational equilibrium of HDM2 in the regulation of p53 binding: Perspectives from molecular dynamics simulation and NMR analysis
Kazuki Watanabe, Qingci Zhao, Ryosuke Iwatsuki, Ryota Fukui, Weitong Ren, Yuji Sugita, Noritaka Nishida
J. Am. Chem. Soc. 2024 Apr 10;146(14):9790-9800.
HDM2(human homolog of mouse double minute 2)はがん抑制因子p53を標的とするE3ユビキチンリガーゼであり、通常時はp53の分解を誘導してアポトーシスを回避する一方で、細胞ストレスによりリン酸化を受けることでp53との結合が抑制されアポトーシスを誘導します。これまでの構造生物学的な解析から、HDM2は一定の構造を取らないN末端のlid領域がcore領域のp53結合部位を覆うclosed状態と、lidが解離してp53結合部位が露出したopen状態の平衡にあることは知られていましたが、その構造的な詳細やN末端領域へのリン酸化がp53との相互作用を負に調節する機構は不明でした(図1A)。
西田グループでは水溶液中におけるタンパク質の動的構造を解析可能なNMR法を用いた解析により、HDM2は従来知られていたopen-closed間の遅い交換速度(slow exchange)の構造平衡に加えて、closed構造の内部において速い交換速度(fast exchange)の構造平衡が存在することを明らかにしました(図1B)。つぎにHDM2のmulti-state構造平衡を可視化するため、杉田グループと共同で拡張アンサンブル法の一種であるgREST法を用いた分子動力学的シミュレーションを行い、2つのclosed構造(closed 1およびclosed 2)を可視化しました(図1C)。得られた2つの構造はNMRスペクトルの変化をよく説明するものであり、FEL(自由エネルギーランドスケープ)解析からHDM2はclosed 2構造を経由してopen構造へ遷移することも明らかになりました。さらに、HDM2のN末端領域S17のリン酸化は、closed 1構造の存在量比を増加させ、p53の結合を阻害することがわかりました。
以上の解析からHDM2のmulti-stateな構造平衡の詳細が明らかになり、通常時ではopen構造のHDM2がp53と結合し分解を促進するのに対し、細胞ストレスに応じたS17リン酸化によってopen構造へ遷移しにくいclosed 1構造が安定化することでopen構造の存在量が減少し、分解を逃れたp53により細胞のアポトーシスが進行するという、新しいp53によるアポトーシス誘導の制御機構を提唱しました(図2)。
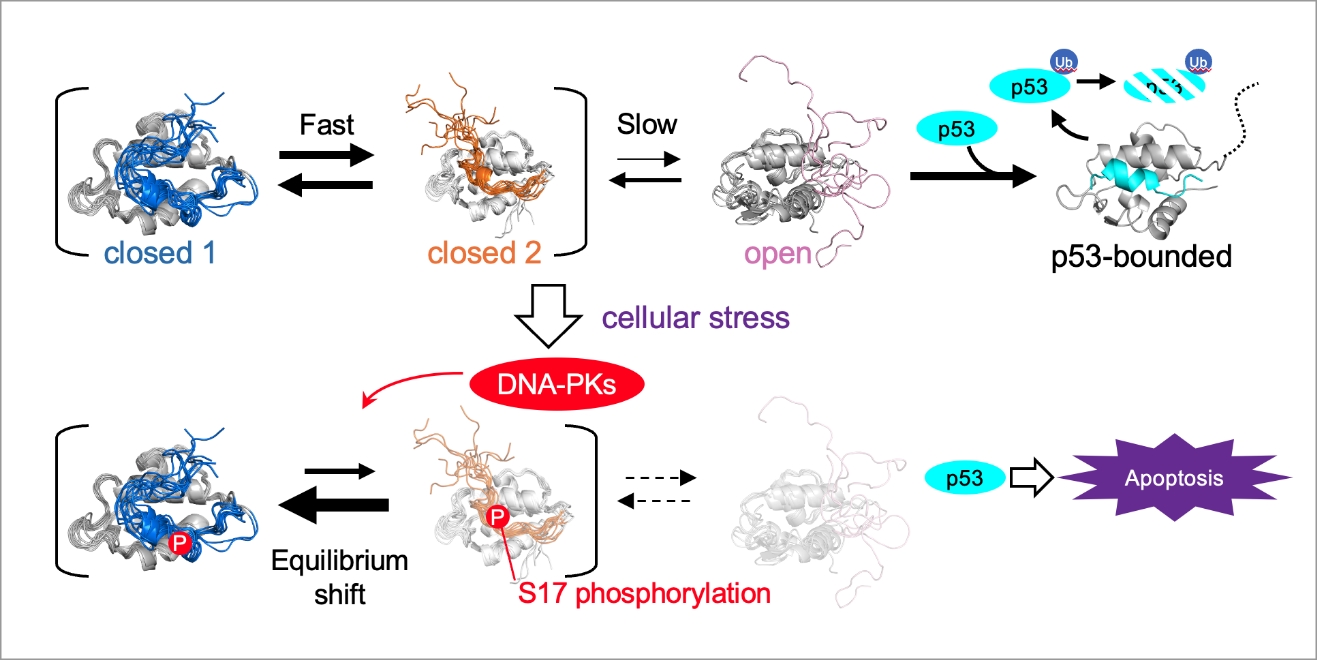
図1:NMRとMDシミュレーションを用いたHDM2のmulti-state構造平衡の可視化
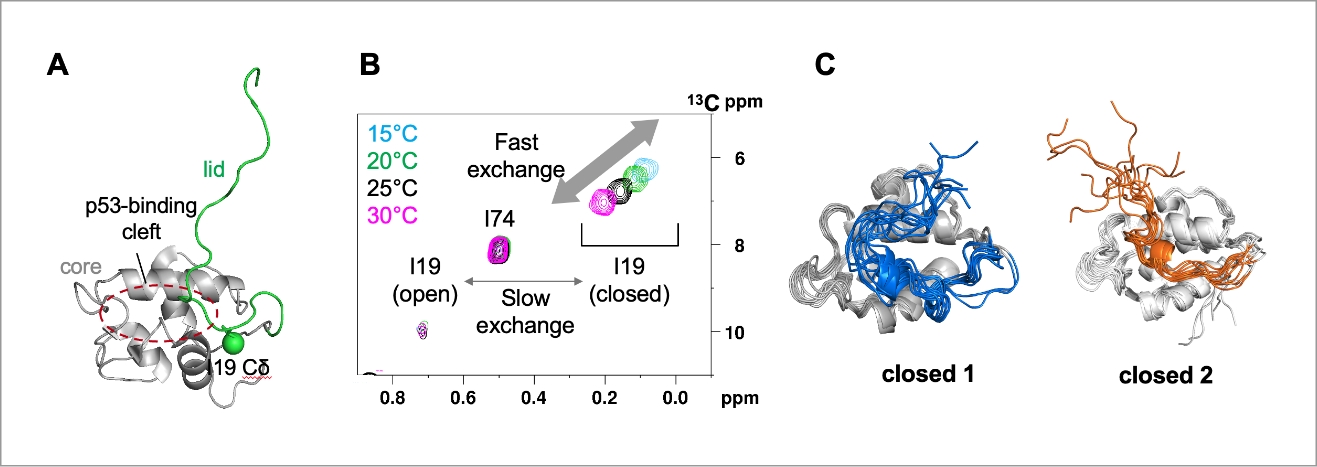
図2:明らかになったHDM2のp53結合制御メカニズム