2022年6月から新たに15つの公募班が本領域に参画し、2022年7月28-29日に開催された第2回領域会議では活発なディスカッションが行われました。本デジタルニュースレターでは、公募班の研究内容について2回に分けて紹介していきたいと思います。
細胞内で区画化されたGPCRシグナル伝達を司るメゾ複合体の解明
研究代表者:柳川 正隆(東北大学 大学院薬学研究科・准教授)
研究内容
私たちの研究グループは、薬の主要な標的分子であるGタンパク質共役型受容体(GPCR)とシグナル伝達分子の相互作用動態を、生細胞内で1分子計測・解析する技術を開発しています。GPCRは形質膜だけでなく、細胞内のエンドソームや核で区画化されたシグナル伝達を行っているという報告がありますが、それぞれの領域でいつどのようにGPCRがシグナル伝達分子と相互作用しているのかは明らかでありません。空間的に異なる細胞領域においてGPCRとシグナル伝達分子が過渡的に形成するメゾ複合体を観察し、シグナル伝達機構を理解することは、薬の効果や作用メカニズムを明らかにする上で重要です。私たちはこれまでに、細胞表面における膜受容体とエフェクターの分子間相互作用を1分子レベルで解析するワークフローを確立してきました。「クロススケール新生物学」では、細胞の任意の領域で1分子計測ができる「ホールセル1分子自動計測システム」を開発し、計測範囲を細胞全体に広げます。本顕微鏡システムの開発により、細胞内で区画化されたGPCRシグナル伝達の詳細が明らかになり、薬理学や創薬分野における研究の進展に寄与することが期待されます。
また、本顕微鏡システムは形質膜・細胞内オルガネラに局在する任意の分子の動態計測に応用可能です。共同研究をつうじて多様な細胞内のメゾ複雑体の1分子計測に挑戦できれば幸いです。

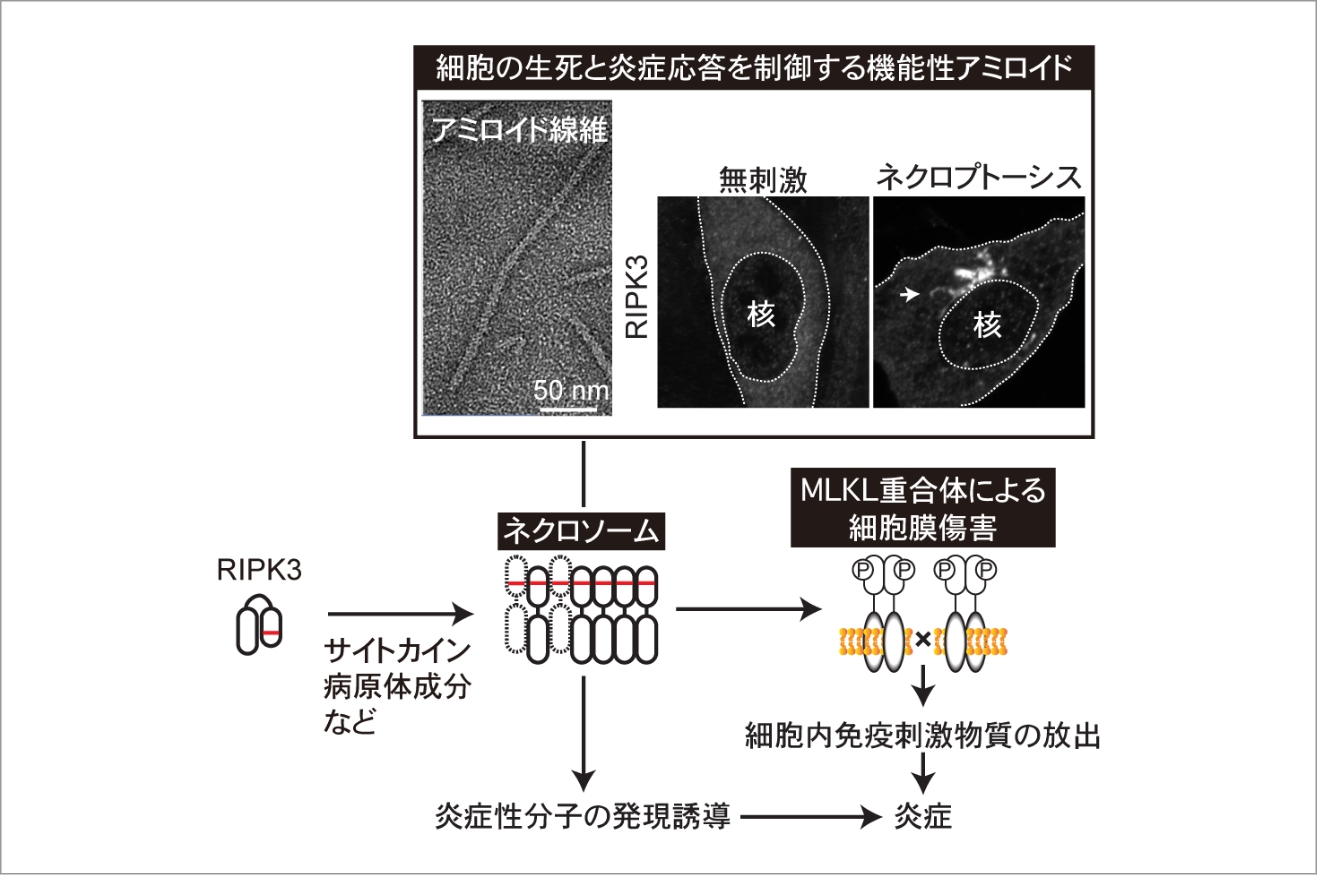
細胞の生死と炎症応答を制御するメゾ複雑体の細胞内分子構造動態の解明
研究代表者:森脇 健太(東邦大学 医学部生化学講座生化学分野)
研究内容
ネクローシスは細胞膜の破裂を伴う細胞死であり、アポトーシスとは異なって、炎症性で且つ免疫原性の高い細胞死である。特定の分子によって制御されるネクローシス(制御性ネクローシス)の1種であるネクロプトーシスは、サイトカインや病原体成分などによって引き起こされ、感染防御や様々な炎症性疾患の病態の増悪に寄与している。ネクロプトーシス誘導時には、マスター制御分子として働くセリン・スレオニンキナーゼRIPK3がネクロソームと呼ばれるタンパク質複合体を形成してその中で活性化し、そして次に細胞膜傷害分子MLKLを活性化して細胞膜の破裂を引き起こす。In vitroでの構造学的解析からRIPK3がアミロイド線維を形成することが分かっており、ネクロソームは細胞の生死と炎症応答を制御する機能性アミロイドであると考えられている。しかし、細胞内でのネクロソームの分子構造や動態は不明であり、そのためにその活性制御機構には多くの謎が残されている。さらにMLKLも細胞膜傷害の実行に際して重合体を形成することがわかっているが、細胞膜上におけるその構造や動態は不明である。本研究では、本領域内で積極的に共同研究を実施することで、ネクロプトーシスを制御するメゾ複雑体の細胞内分子構造動態を明らかとし、その活性制御機構を解明する。本研究で得られる成果は、ネクロプトーシスによる炎症誘導機構の解明、また炎症性疾患の病態の理解と新規治療法の開発に繋がると期待される。
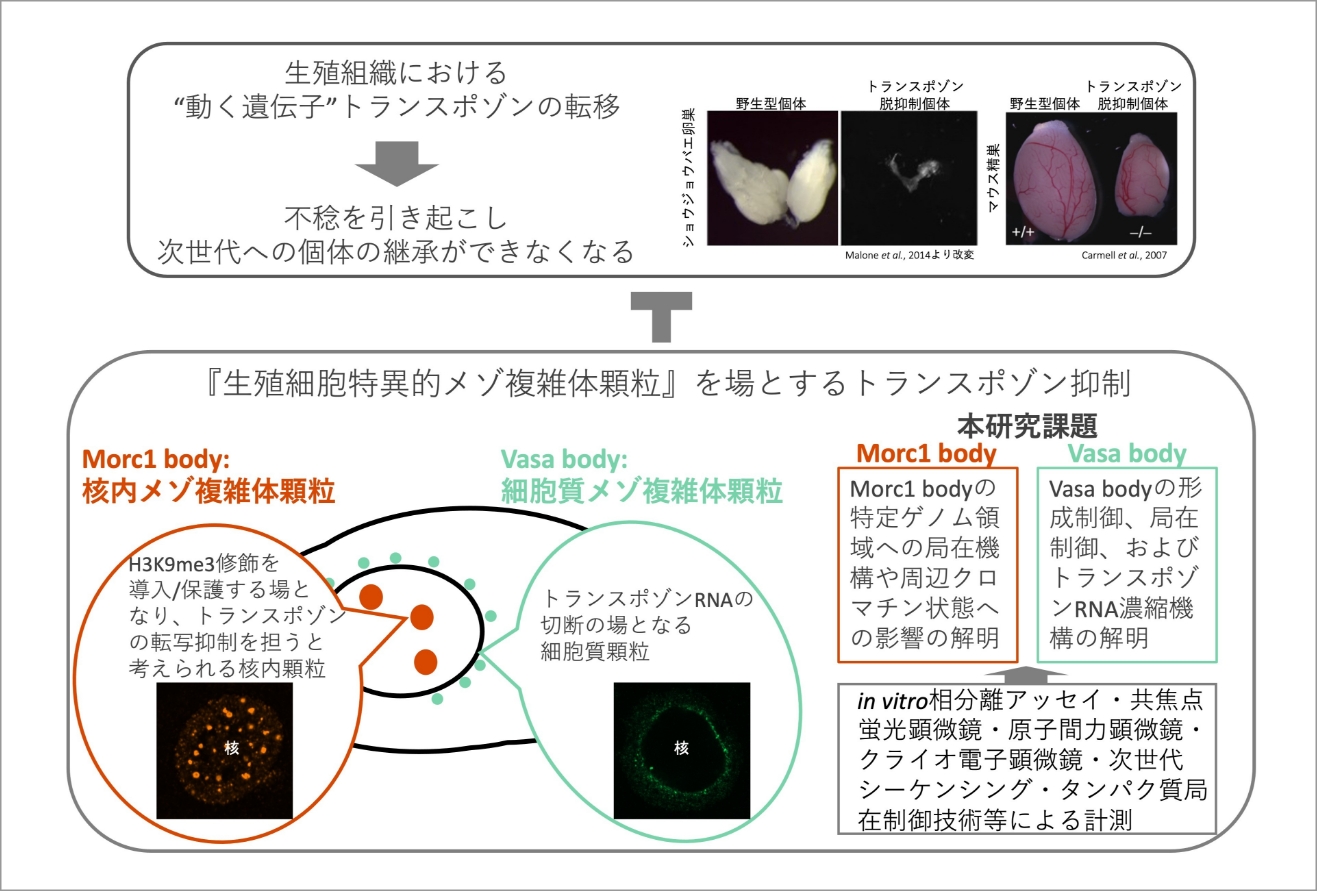
メゾ複雑体顆粒による生殖細胞のゲノムインテグリティ維持機構の解明
研究代表者:山崎 啓也(東京大学大学院理学系研究科生物科学専攻・助教)
研究内容
生殖細胞における「動く遺伝子」トランスポゾンの制御不全は、不稔を引き起こす可能性がある。この制御に関与する細胞内構造として、生殖細胞にのみ存在し、固有の機能を持つメゾ複雑体がある。これらは膜を持たないオルガネラの一種であり、生殖細胞特異的なVasa bodyとMorc1 bodyがその代表例である。Vasa bodyは細胞質に、Morc1 bodyは核内に局在し、それぞれ異なる機構でトランスポゾンの抑制に寄与する。Vasa bodyはトランスポゾンRNAの切断の場として機能すると考えられている。一方、Morc1 bodyは抑制性ヒストン修飾H3K9me3の導入と維持を担い、トランスポゾンを抑制し、生殖細胞のゲノム安定性を維持すると推測される。
我々の先行研究では、Vasa bodyの形成機構とトランスポゾン抑制における役割を明らかにした。具体的には、Vasaタンパク質のN末端天然変性領域による自己会合と、ヘリカーゼドメインを介した長鎖RNAとの相互作用が相分離を誘導し、Vasa bodyを形成することを示した。さらに、この構造体にトランスポゾンRNAが濃縮されることも解明した。また、Morc1 bodyの機能に関する初期的知見も得た。
本研究では、これらの成果を基盤として、Vasa bodyの形成制御、局在制御、およびトランスポゾンRNA濃縮機構をより詳細に探究する。同時に、Morc1 bodyの特定ゲノム領域への局在機構や周辺クロマチン状態への影響を解明することを目指す。
研究手法としては、これまで我々が用いてきたin vitro相分離アッセイに加え、領域内での共同研究として共焦点蛍光顕微鏡、原子間力顕微鏡、クライオ電子顕微鏡、次世代シーケンシング、タンパク質局在制御技術などを用いた、多様なスケールでの定量的解析を実施したいと考えている。
この研究を通じて、生殖細胞特異的メゾ複雑体の形成から、トランスポゾン抑制に至る機構が、分子レベルからオルガネラレベルまで包括的に解明されることが期待される。これにより、生殖細胞におけるゲノム安定性維持機構の理解が深まると考えられる。
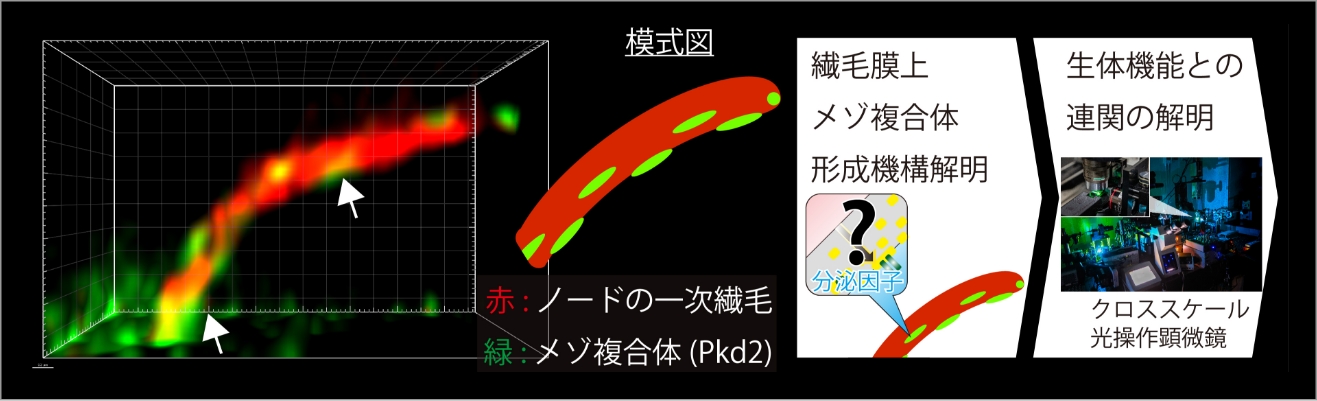
クロススケール顕微鏡から迫る、メゾ複合体の秩序性と生体機能制御
研究代表者:加藤 孝信(東京大学・助教)
研究内容
細胞から生えた毛のような小器官である一次繊毛は、細胞のアンテナとして知られ、細胞外環境の受容を担う。我々は、この一次繊毛上に機械受容体がクラスター状に集積したメゾ複合体が存在し、その秩序性が初期胚発生における左右軸決定に不可欠であることを発見した。しかし、その形成機構は全く不明である。また、一次繊毛全般で同様の構造が形成され機能していると予想されるが、その実態も明らかにされていない。
本研究では、上記を発展させ、受容体クラスター形成機構を追求する。並行して、身体全体で網羅的に解析するために、新規透明モデル魚を用いて超解像顕微鏡観察から個体全体のライトシート顕微鏡観察と光ピンセット法による力学操作までをシームレスに行うクロススケール光操作顕微鏡を開発する。生体深部における一次繊毛上の受容体クラスターと機能解析を実現し、繊毛膜上の秩序的メゾ複合体による生体機能制御という新たな概念の確立を目指す。