2022年6月から新たに15つの公募班が本領域に参画し、2022年7月28-29日に開催された第2回領域会議では活発なディスカッションが行われました。本デジタルニュースレターでは、公募班の研究内容について2回に分けて紹介していきたいと思います。
クロススケール核膜孔内選択的分子輸送システムの解明とその破綻
研究代表者:Richard Wong(金沢大学 ナノ生命科学研究所・教授)
研究内容
当研究班の目的は、我々のグループらが確立してきた独自のイメージング技術により、選択的核膜分子輸送システムの基盤となる相分離のメゾ動態と機能化メカニズムを解明する。核膜孔が形成する相分離の根本的な理解により、生命現象の基盤である核膜物質輸送機序の解明は勿論、発がん機序解明やウイルス感染応答に対する理解が深化し、相分離を指標とした細胞診断や治療法開発への発展が期待される。
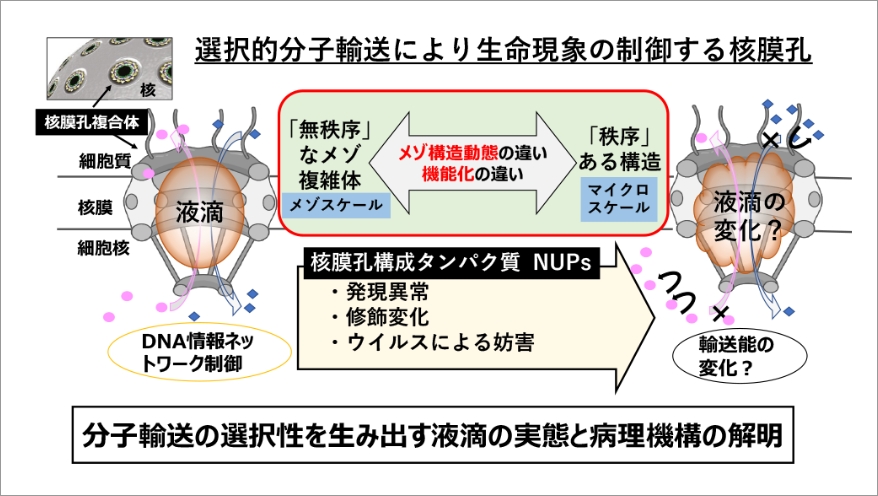
核膜孔複合体(NPC: Nuclear Pore Complex)は、細胞内の「メゾ複雑体」小器官の一つである。NPCは、核内DNAへアクセスするための唯一の分子輸送孔(核膜孔)を形成するタンパク質複合体であり、核-細胞質間の分子輸送を調節し、DNA情報ネットワークを選択的に制御する。NPCは約30種類のヌクレオポリン(NUPs)からなり、特定のNUPsはフェニルアラニンーグリシン(FG)リピート配列を持つ(FG-NUPs)。このFGリピート配列は、決まった構造を取らず、FGリピートを介した分子間相互作用は相分離を駆動し、核膜孔内部に液滴を形成する。しかしながら、この内部液滴はメゾスケールかつ環境依存的に変化しやすい構造であるため、詳細な解析はできてはおらず、結果としてFGネットワークダイナミクスは十分には理解されていない。 本研究では、「メゾ複雑体」核膜孔の作動原理の基盤となる相分離の理解にむけて、核膜孔内部に形成される液滴のメゾ構造動態と機能の相関をクロススケールで解明する。
細胞の左右極性を決定するメゾ複雑体の同定
研究代表者:稲木 美紀子(大阪大学大学院理学研究科生物科学専攻・講師)
研究内容
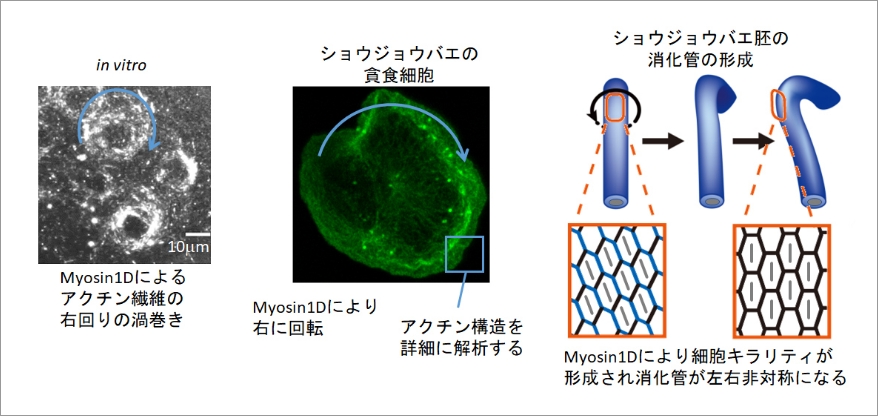
生物の体は、前後軸、背腹軸のほかに左右の軸をもち、それに従って左右非対称な内臓の位置や形が決められています。近年、組織を構成する個々の細胞自身も内在的な左右非対称性をもつことが明らかとなっています。この細胞の左右非対称性である細胞キラリティは、ショウジョウバエ胚の後腸上皮細胞で初めて発見され、1型ミオシンの一つであるMyosin1Dがその向きの決定に重要であることが示されています。細胞キラリティは、その後様々な生物種由来の培養細胞でも見つかり、細胞のもつ普遍的な属性であることが示されつつありますが、その分子的起源は明らかとなっていません。申請者らは、試験管内でMyosin1Dがアクチン繊維のキラルな渦巻きを誘導することを発見し、これが細胞キラリティの分子的起源なのではないかと考えました。本研究課題では、顕微鏡観察に適したショウジョウバエの貪食細胞を用いて、細胞内分子構造動態解析技術を駆使して、細胞の左右極性を決定するメゾ複雑体の発見を目指します。
メゾ複雑体のストイキオメトリーを計測する超高感度定量プロテオミクス技術の開発
研究代表者:増田 豪(慶應義塾大学 先端生命科学研究所・特任講師)
研究内容
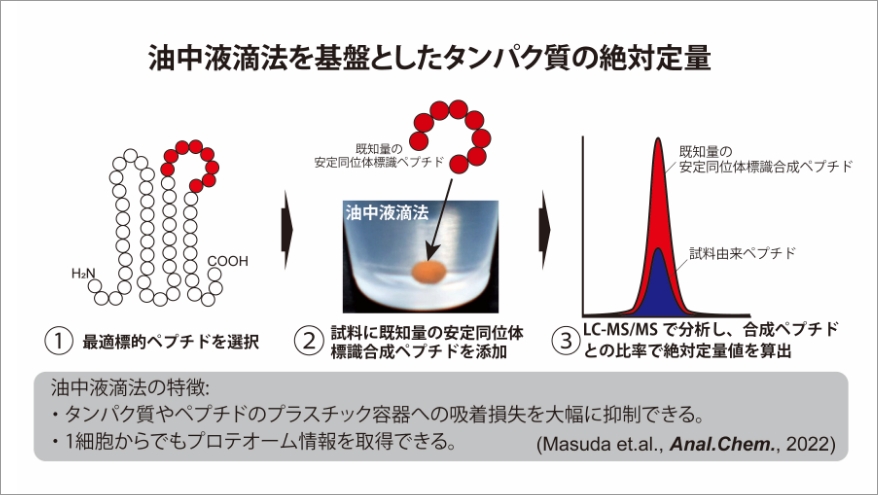
メゾ複雑体の細胞内分子構造動態を観察することは、それらが関与する未だ明らかになっていない複雑な生命現象の解明には欠かすことはできない。メゾ複雑体の動的観察はこれまで、主にクライオ電子線トモグラフィーや原子間力顕微鏡などが用いられてきた。これら技術を用いることで、分子やタンパク質レベルの計測手段では明らかにすることが難しかったメゾスケールな動的変動の観察を可能としてきた。一方で、これらの計測技術ではメゾ複雑体を構成するタンパク質の種類を明らかにすることはできない。クロススケール生物学を進めるにはこれらの計測技術に加えて、複数のタンパク質の量的変動を捉えられる網羅性を有し、さらにそれらタンパク質群の存在比率(ストイキオメトリー)を計測することができる絶対定量が可能なプロテオミクス計測技術が必要である。また、メゾ複雑体の存在量は種類によって多様である。どのメゾ複雑体でも計測するためには超高感度に分析できる技術が望まれる。本研究では、私たちが1細胞プロテオミクス用に開発した微量試料用サンプル処理方法である油中液滴法を用いる。また、既知量の合成ペプチドを指標としてメゾ複雑体を構成するタンパク質群の定量を行う。
タンパク質は様々な生命現象に深く関与しています。私は、新しいプロテオミクス技術を開発することで新しい生命現象を観察することを目指しています。特に1個の細胞など試料量が限定されているものでもプロテオミクスできるような技術開発を行っています。ご興味がございましたらぜひご連絡ください。
局所光操作と蛍光寿命イメージングによるシナプス内メゾスケール組織化機構の解明
研究代表者:村越 秀治(生理学研究所 脳機能計測・支援センター・准教授)
研究内容
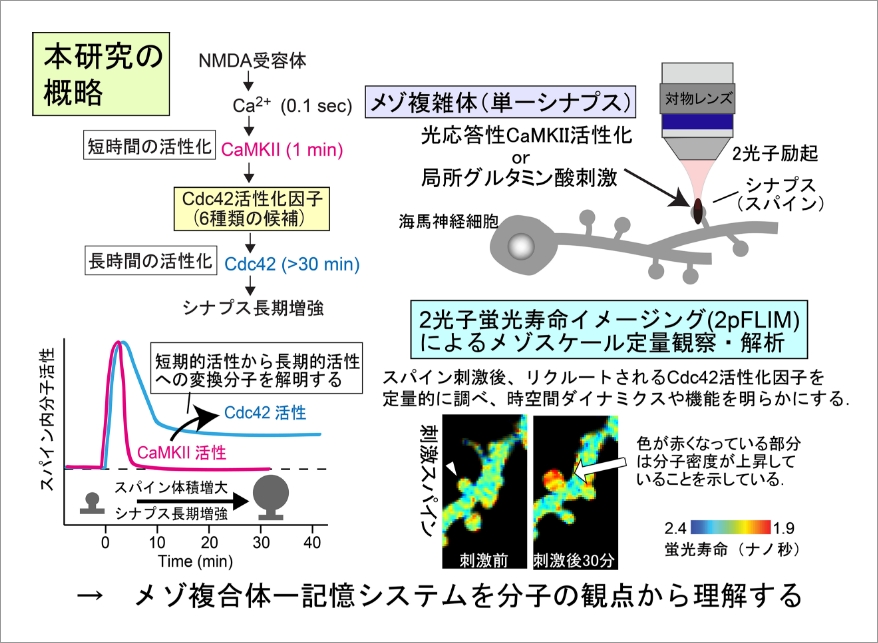
神経回路の形成と機能の基礎となるシナプスは数万タンパク質分子からなる300ナノメートル程度のメゾ複雑体である。その形態・体積や内部構造は動的に制御されており、動物の記憶メカニズムの基礎と考えられている。これまで私達は、蛍光寿命イメージング顕微鏡法(FLIM)により、海馬興奮性シナプスにおいて、短時間のCa2+流入およびCaMKII活性化が局所的かつ動的な長時間の低分子量Gタンパク質(Cdc42)活性に変換されることがシナプス長期増強の基礎となっていることを明らかにした。しかしながら、このタイムスケール変換メカニズムは分かっておらずシナプス研究の重要な課題となっている。Cdc42の長時間活性化(メモリー分子)は長期間の記憶の維持と直接関係している可能性があることから生物学的に極めて重要である。本研究では、Cdc42の活性化因子(脳の遺伝疾患関連因子を含む)に着目し、網羅的にそれらのダイナミクスと分子機能を蛍光寿命イメージング顕微鏡法と局所分子光操作法により明らかにする。このようにして、メゾ複雑体であるシナプスにおいて、短時間シグナルを長期持続シグナルに変換するメカニズムを分子集合・離散の観点から明らかにし、記憶システムや脳の遺伝疾患メカニズムの解明につなげたい。
2pFLIMでは、GFP等の蛍光標識したタンパク質の分子間相互作用や分子結合・解離を生きた細胞や組織内で観察することができます。共同研究者が作製したプローブ(事前に詳細を相談)を遺伝子導入し、培養細胞や組織内で分子の会合状態や局在を観察するといったことを日常的に行っています。機会がありましたらお声掛けして頂ければと思います。
メゾ複雑体ユビキチン液滴が司るタンパク質分解
研究代表者:土屋 光 (東京都医学総合研究所・主任研究員)
研究内容
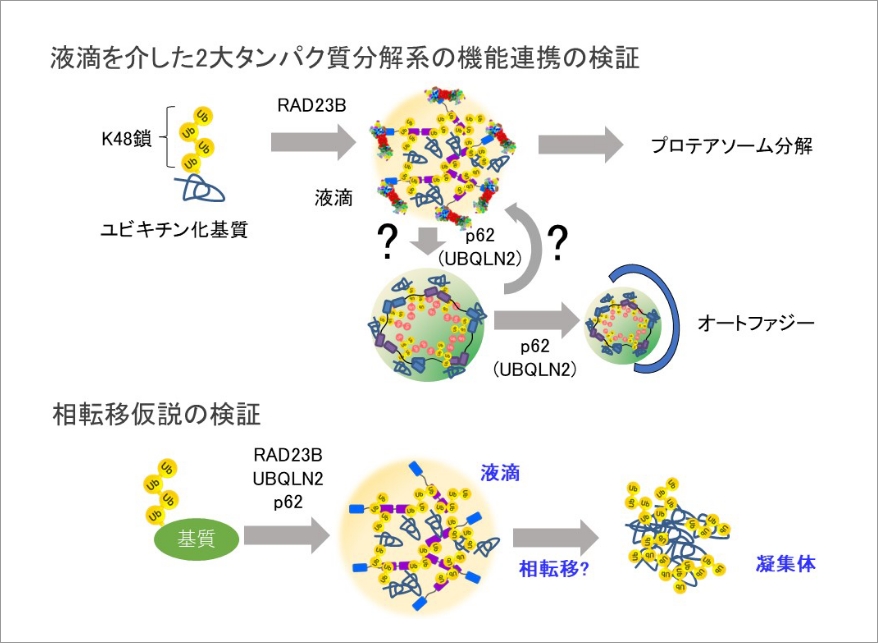
ユビキチン・プロテアソーム系はユビキチン化されたタンパク質を選択的に分解することによりタンパク質恒常性の維持に必須の役割を果たしている。最近、プロテアソームが高浸透圧ストレスに応答してユビキチン化基質と液-液相分離(LLPS)し、核や細胞質にメゾスケールの液滴を形成することを見出した。これらプロテアソーム液滴の形成は、ユビキチン鎖と専用のユビキチンデコーダーRAD23Bの多価相互作用が駆動力となる。高浸透圧刺激以外にも様々なストレスに応答してユビキチン化基質とプロテアソームが液滴構造を形成すること明らかとなってきた。一方で、ユビキチン選択的オートファジーやストレス顆粒においてもp62やUBQLN2などのユビキチンデコーダーがキー分子となりユビキチンを含有する液滴様構造体を形成することがわかってきた。これらのことから液-液相分離の観点からタンパク質分解系を解析する必要性があると考えられる。私たちは、プロテアソームの動態解析の過程でタンパク質合成ストレスによりプロテアソームとオートファジーアダプターp62がユビキチン化基質を介して共に相分離することを明らかにした。この液滴のクリアランスにはプロテアソームとリソソームの活性どちらも必要であることから、液滴を介してユビキチン・プロテアソーム系とオートファジー・リソソーム系が協調的に機能していると考えられる。そこで本研究ではメゾ複雑体としてのユビキチン液滴を介したプロテアソームとオートファジーの連携機構を解明する。
ユビキチン液滴の制御分子はいずれも神経変性疾患の関連因子であるため、ユビキチン陽性凝集体の形成にも関与する可能性が示唆されている。そこで本研究では、上記ユビキチン液滴をモデルとしての相転移仮説の検証にも挑戦したいと思います。是非共同研究を実施できたらと思います。
細胞骨格制御シグナル伝達における細胞内分子構造動態の解析
研究代表者:柊元(新野) 睦子 (国立研究開発法人 理化学研究所 生命機能科学研究センター・上級技師)
研究内容
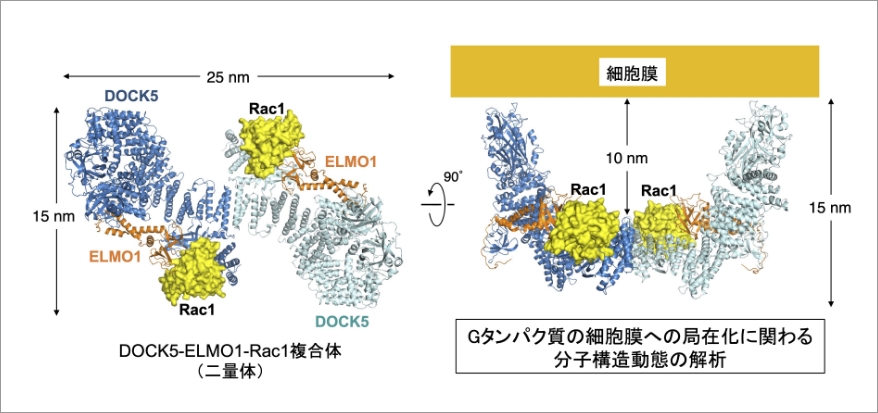
私たちが研究しているメゾ複雑体は、アクチン細胞骨格を制御するDOCK(Dedicator of cytokinesis)とその結合分子によって形成されるシグナル伝達タンパク質複合体です。DOCKファミリーは進化的に保存された非典型のグアニンヌクレオチド交換因子(GEF)で、Gタンパク質RacとCdc42の活性化を通じてアクチン重合を促進します。11種類のヒトDOCKファミリー分子は、神経系の形成や免疫制御に重要な役割を果たしています。 これまでのクライオ電子顕微鏡を用いた単粒子解析により、DOCK5、制御タンパク質ELMO1、基質Gタンパク質Rac1の三者複合体は、湾曲した二量体構造を持つことが明らかになっています(Kukimoto-Niino et al., Sci. Adv., 2021)。このDOCK5-ELMO1-Rac1三者複合体は、DOCK5二量体の両端にあるリン脂質結合ドメインで細胞膜に結合することが示唆されました。しかし、Rac1と予想される細胞膜表面の間にはおよそ10 nmのギャップがあり、DOCKが細胞膜に局在するRacとどのように相互作用するかについてはまだ分かっていません。
本研究では、脂質膜上など細胞内環境に近い条件下でのDOCKシグナル伝達タンパク質複合体の構造動態を、クライオ電子顕微鏡による単粒子解析(当グループ)とクロススケール計測技術(杉田グループ、Wongグループとの共同研究)を用いて解析します。本研究は、Gタンパク質の細胞内局在と活性を制御する新たな分子メカニズムの発見につながると期待できます。
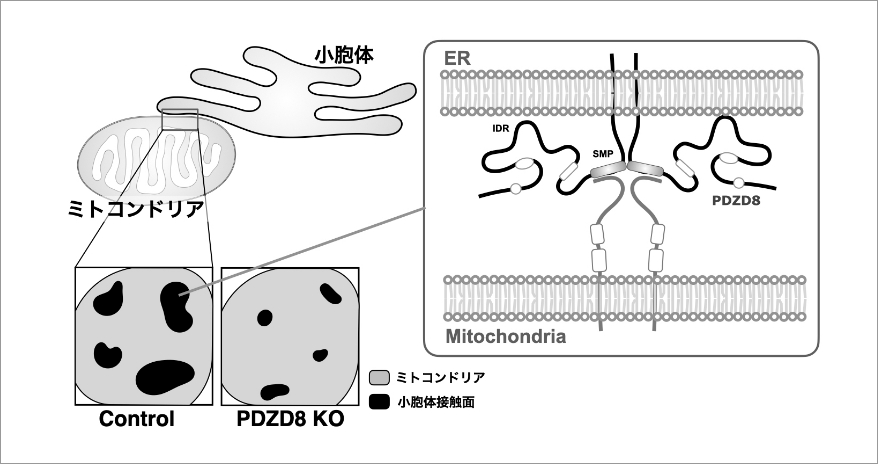
小胞体ーミトコンドリア接触の可塑的制御メカニズムの解明
研究代表者:平林 祐介(東京大学大学院工学系研究科化学生命工学専攻・准教授)
研究内容
小胞体とミトコンドリアの物理的な接触(小胞体―ミトコンドリア接触)は多くの細胞において最も顕著に観察されるオルガネラ間接触である。この接触部位においては、異なるオルガネラの脂質膜、タンパク質、核酸、イオンといった複雑な要素が数十nm立方の空間に密集し、まさにメゾスケールの複雑体を形成している。本クロススケール新生物学領域において、我々のグループは、小胞体―ミトコンドリア接触について(1)連続切片電子顕微鏡画像からの面積・形状の計測と解析系の開発、(2)サイズ・形状の制御の分子メカニズムの解明を、最近我々が開発した深層学習を用いた連続切片電子顕微鏡画像解析手法と分子生物学・生化学的手法を組み合わせ行っている。そして、タンパク質間相互作用、相分離 (Phase separation) などの様々な力学的作用を生み出す分子機構と細胞内微細構造を繋ぐことを目指す。最近では、小胞体上を活発に動く小胞体タンパク質PDZD8がミトコンドリア近傍に一時的に停留することや、PDZD8とミトコンドリアタンパク質FKBP8との相互作用が小胞体―ミトコンドリア接触に重要であることを見出している (Nakamura, Aoyama-Ishiwatari, Nagao et al., bioRxiv, 2023)。
我々が開発した深層学習ベースの画像解析プラットフォームPHILOW (Suga et al., PLOS Biology, 2023)はGitHubから誰でも入手可能ですので、ぜひ使ってみて頂き、不明な点がありましたらご連絡ください。また、領域内の共同研究として最近、藤芳グループと共にこれまでの分解能を大きく凌駕するクライオ顕微鏡の開発も行っております。