2022年6月から新たに15つの公募班が本領域に参画し、2022年7月28-29日に開催された第2回領域会議では活発なディスカッションが行われました。本デジタルニュースレターでは、公募班の研究内容について2回に分けて紹介していきたいと思います。
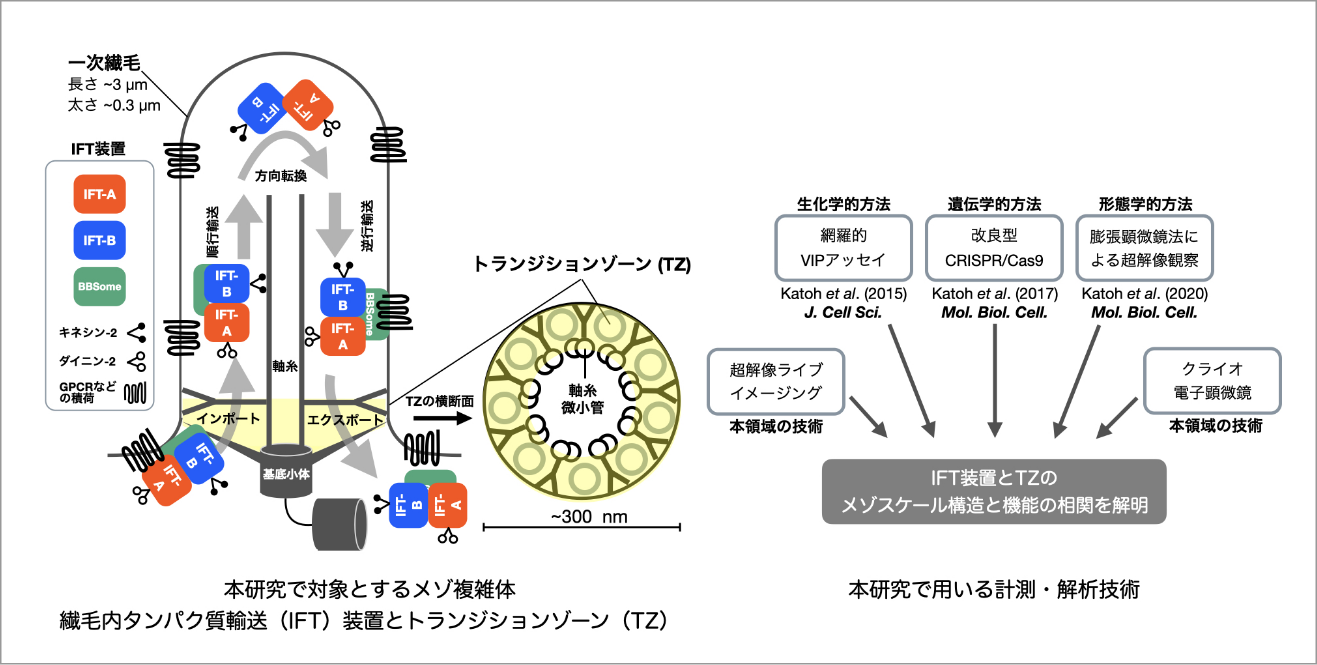
繊毛内タンパク質輸送装置とトランジションゾーンのメゾスケール構造-機能相関の解明
研究代表者:加藤 洋平(京都大学大学院薬学研究科生体情報制御学分野・講師)
研究内容
一次繊毛は細胞のアンテナとして機能するオルガネラであり、その異常は多様な重篤症状を呈する繊毛病を引き起こす。一次繊毛の形成や機能維持において基盤となるのは、繊毛内に受容体等を輸送する繊毛内タンパク質輸送(Intraflagellar transport: IFT)装置である。また、IFT装置と連携して繊毛タンパク質の出入りを制御しているのは、繊毛の基部に存在するトランジションゾーン(Transition zone: TZ)である。円柱状のTZは直径が約300nm、高さも約300nmの正にメゾスケール複雑体と言える。この極小領域に多種多様なTZタンパク質が集積しているが、それらがどのような構造をとって機能しているかは、光学顕微鏡の分解能の限界に阻まれ解明できていない。本研究ではIFT装置とTZの構造と機能の相関を解明するために、膨張顕微鏡法(Expansion microscopy:ExM)と超解像顕微鏡を用いた『超々解像イメージング』を主軸に、生化学的・遺伝学的アプローチを加えた多角的解析を行う。さらに、本学術変革領域の持つ最先端の計測・解析技術を取り入れることでIFT装置とTZのクロススケール構造-機能相関の解明を目指している。
膨張顕微鏡法は私たちの研究だけでなく本領域の班員の方々の研究にも役立つ技術と思っています。これまでに私たちは膨張顕微鏡法のProExM法とU-ExM法のプロトコールを確立していますので、ご興味がございましたらぜひご連絡ください。また、VIPアッセイに利用しているNanobody(蛍光タンパク質や抗体に結合するものなど)の提供や、CRISPR/Cas9によるKO細胞作製などでお役に立てることがあれば幸いです。
メゾ複雑体としてのシナプスの発達様式を統括的に理解するための深層学習による挑戦
研究代表者:小金澤 紀子(群馬大学大学院医学系研究科 薬理学・助教)
研究内容
脳内の神経ネットワーク内で神経細胞間の情報を伝達する際にシナプス前部から神経伝達物質が放出されてシナプス後部に濃縮する神経伝達物質受容体に結合する。発達中の神経細胞内のシナプスは、100~500nm程度の大きさで、その形態をダイナミックに変化させていることから、メゾ複雑体であると言える。シナプスの形成異常が自閉症スペクトラム障害(ASD)の発症につながる可能性が考えられていることから、シナプス微細形態が発達中にどのように変化するかは基礎生物学だけでなく臨床医学の面からも非常に重要な研究課題である。
我々は、シナプス形成の制御機構について超解像3D-STED顕微鏡を駆使して研究してきた。この顕微鏡を使うことで、シナプス形態が三次元かつ高分解能で観察可能になる。本研究ではシナプス微細形態を観察するためにまず、超解像3D-STED顕微鏡と膨張顕微鏡法を組み合わせて三次元でさらに高い分解能が得られる超解像蛍光顕微鏡法(3D-ExSTED)を開発する。次に、3D-ExSTEDを駆使してシナプス微細形態を観察する。こうして得られる膨大な数の画像データを深層学習とベイジアンネットワークで解析することで、これまで不明な点が多かったシナプス微細形態を明らかにする。そして、この手法を各発達段階のマウス脳内のシナプスの解析とASDモデル動物のシナプスの解析に応用する。本研究の結果が将来的にASD病態の解明につながる可能性が期待できる。
すでに、3D-ExSTEDを使って予備的データの取得に成功した。画像解析に関して杉田班との共同研究を始めており、多彩なシナプス微細形態を分類する手法を検討中である。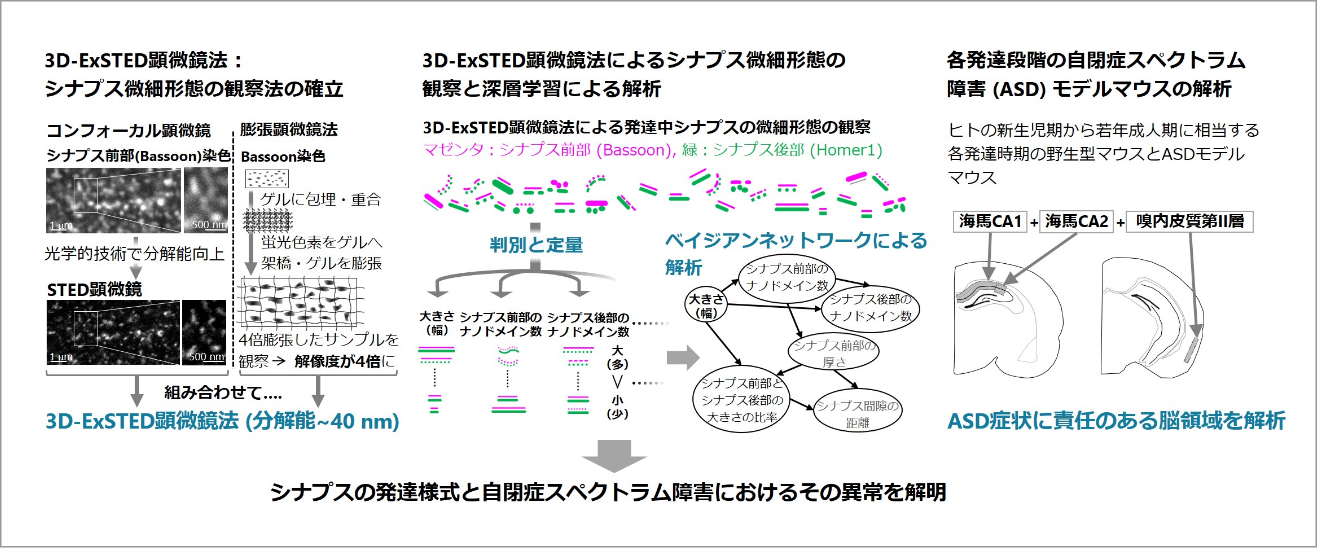
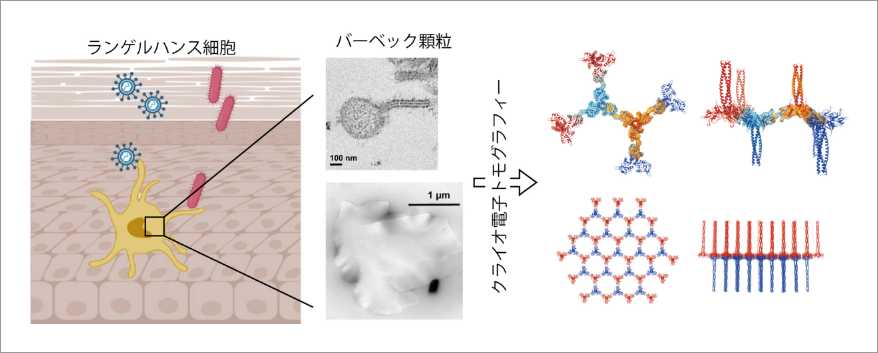
クライオ電子トモグラフィーを用いたバーベック顆粒による免疫防御機構の解明
研究代表者:小田 賢幸(山梨大学大学院総合研究部医学域解剖学講座構造生物学教室・教授)
研究内容
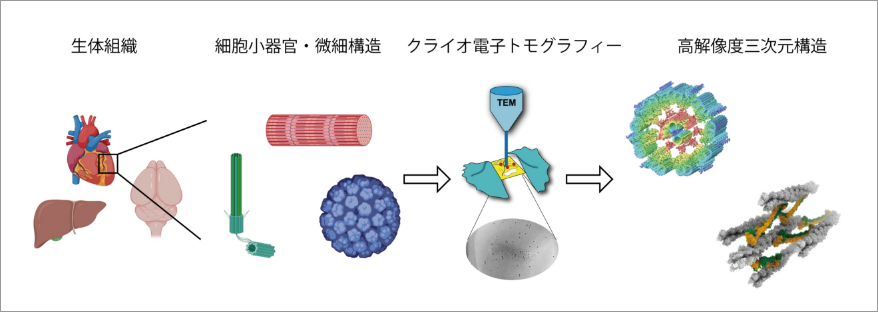
当研究班の目的はクライオ電子トモグラフィー法を用いて、生体から単離・精製した細胞小器官や特殊な膜構造の三次元構造を明らかにすることです。表題のプロジェクトはヒトの体内で働く自然免疫機構を研究対象としています。ヒトの皮膚や粘膜には「ランゲルハンス細胞」と呼ばれる特殊な免疫細胞があり、侵入してくる病原体を捕らえ、免疫応答を誘導しています。ランゲルハンス細胞は特にヒト免疫不全ウイルス(HIV)の経膣感染からの防御に働いていることが知られています。ランゲルハンス細胞に捕らえられた病原体は「バーベック顆粒」と呼ばれるテニスラケットのような形状をした小胞に収められますが、このバーベック顆粒がどのような構造をしていて、どのように菌やウイルスに対する免疫に関わっているのか不明でした。本研究では、クライオ電子顕微鏡を用いてバーベック顆粒の三次元構造を解析することでHIV感染防御の分子機構を明らかにしようとしています。バーベック顆粒を極低温下で撮影しトモグラフィーと呼ばれる方法を用いて解析したところ、ランジェリンと呼ばれるタンパク質が向かい合いながら互い違いに結合することで、約10ナノメートル周期の「蜂の巣構造」を形成していることがわかりました。バーベック顆粒のテニスラケット構造の「柄」の部分は、この蜂の巣構造を真横から見た断面だったのです。蜂の巣構造を詳しく調べると、ランジェリンの側面から伸びるループ構造が鍵と鍵穴の関係のように隣接するランジェリンの凹みにはまることでランジェリン同士が結合していることがわかりました。このループ構造に遺伝子変異を導入するとバーベック顆粒の形成が阻害され、細胞内へのHIV取り込みも大きく減少しました。このようにクライオ電子トモグラフィー法を用いて、私達は細胞内に存在する様々な超微細構造の構造と機能を解析していきます。
軸索輸送モーターKIF5Aによる長距離輸送機構と疾患のクロススケール解析
研究代表者:丹羽 伸介(東北大学学際科学フロンティア研究所・准教授)
研究内容
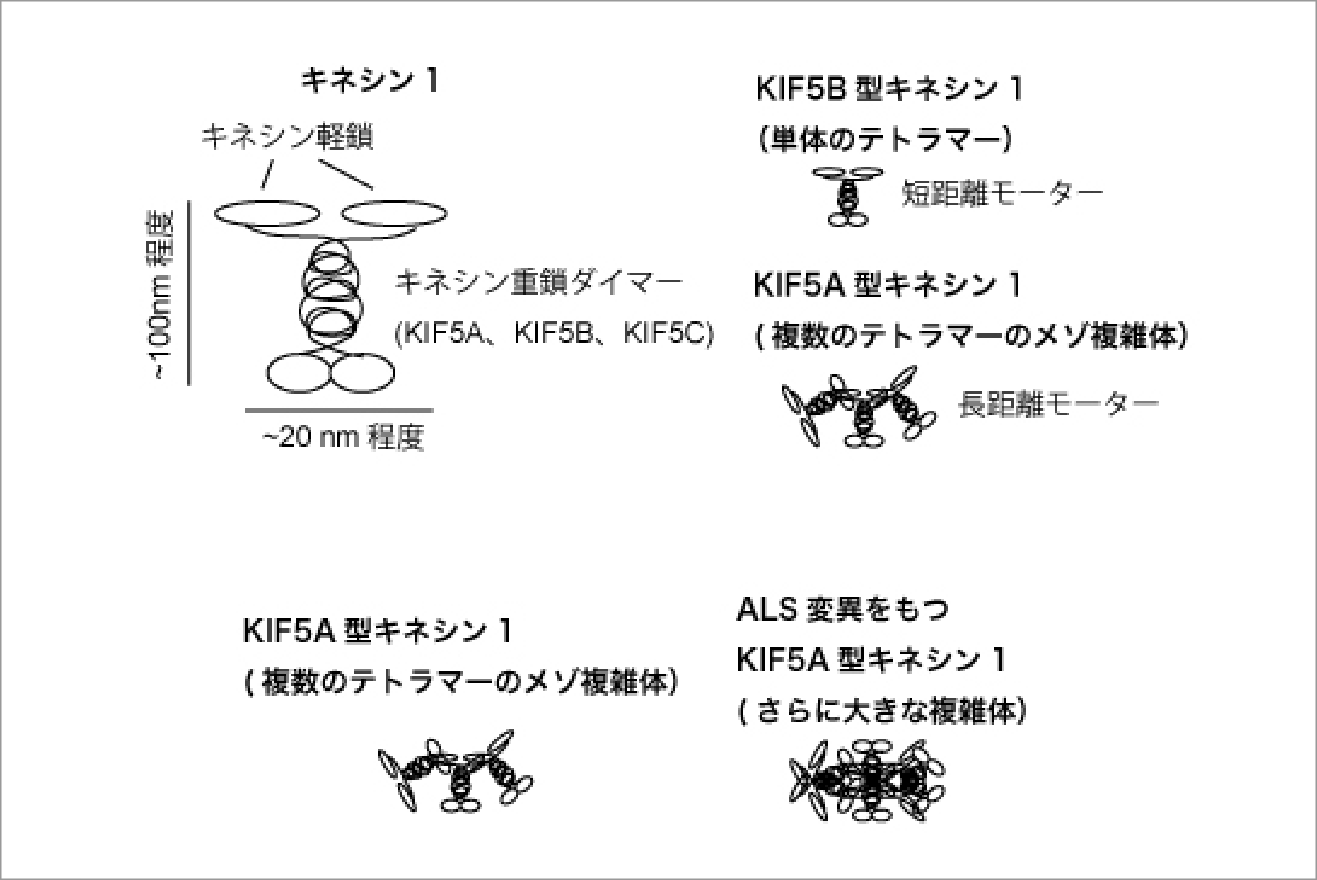
キネシンスーパーファミリー(KIF)は軸索輸送や細胞分裂を担う分子モータータンパク質である。キネシンスーパーファミリーの中で一番最初に見つかり「キネシン」と名付けられた分子モーターは重鎖2サブユニットと軽鎖2サブユニットから構成されている。キネシンの重鎖は哺乳類の場合はKIF5A、KIF5B、KIF5Cの3つの遺伝子でコードされている。その中でもKIF5Aは神経細胞に豊富に発現しており、ミトコンドリアのようなオルガネラのメートルスケールのオーダーの長距離の軸索輸送を担う。
私たちはKIF5A、KIF5B、KIF5Cを精製し、その特性を比較してきた(Chiba et al., Cell Rep., 2022)。KIF5AはKIF5BやKIF5Cに比べて長距離運動をする性質を持っていた。この性質の由来は、複数のKIF5Aモーターが会合したメゾスケール複雑体を形成することではないかと考えられた。
一方で、筋萎縮性軸索硬化症(ALS)や幼児ミオクローヌスといった神経疾患を引き起こすKIF5A遺伝子の変異はメゾスケール複雑体の形成を異常に促進する可能性が示唆された(Nakano, Chiba and Niwa, Genes to Cells, 2022)。本研究ではKIF5Aモーターのメゾスケール複雑体形成メカニズムとその破綻が引き起こすALSについて、モーターの生化学、モーターの1分子計測、疾患モデル線虫の分子遺伝学(以上3点は私たちのグループが担当)、構造生物学(計画班仁田グループとの共同研究)を駆使したマルチスケール解析を駆使して解明したい。
メゾ複雑体内の1分子構造動態計測のための高速3次元超解像顕微鏡開発
研究代表者:池崎 圭吾(東京大学大学院 理学系研究科 物理学専攻・助教)
研究内容
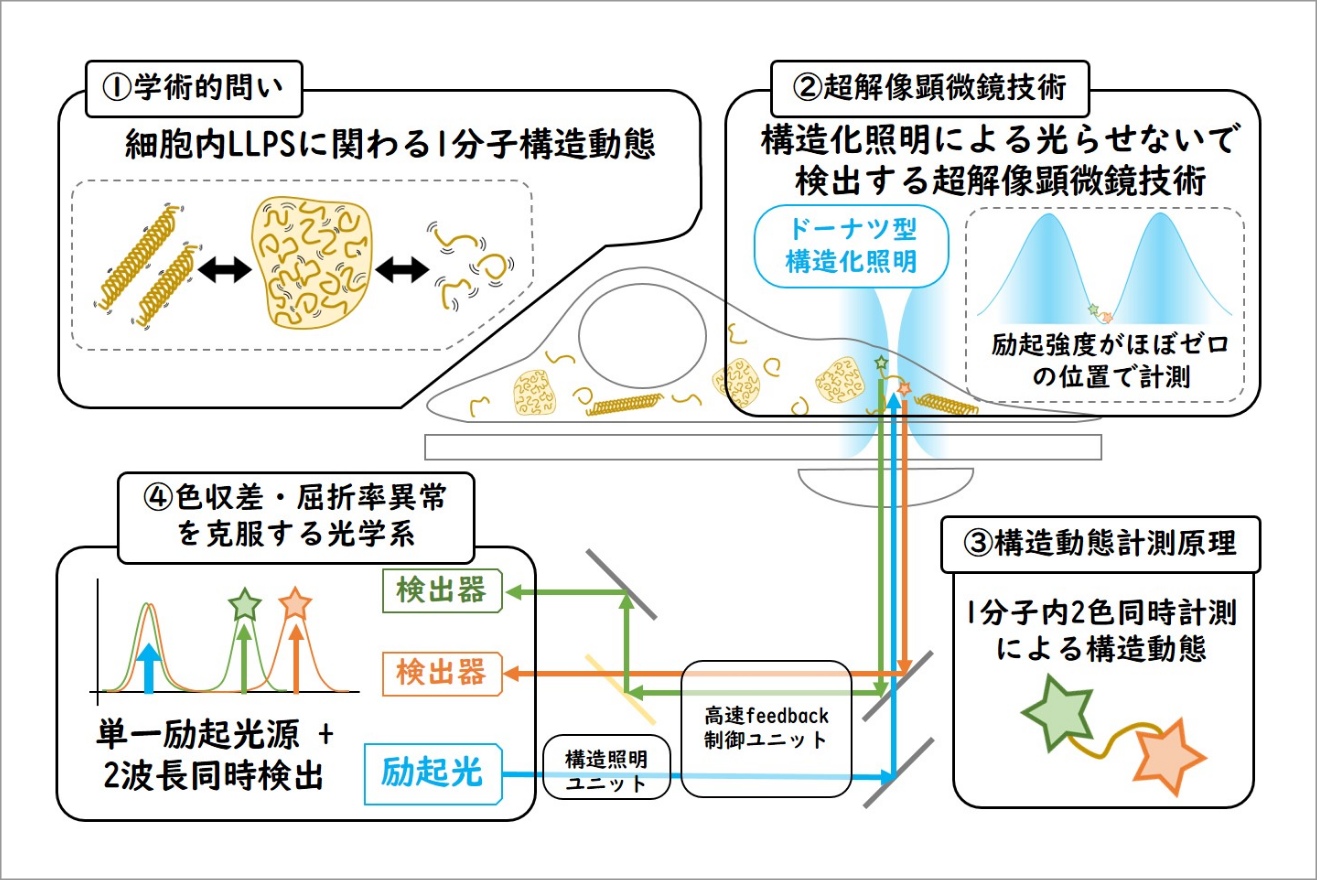
細胞内を無秩序に動き回る酵素などの生体高分子は時に集合し秩序を持つことで細胞骨格やオルガネラ、サルコメアなどのマクロな構造体を作り高次機能を果たしている。近年、このような秩序だった構造体だけでなく無秩序な高次構造体(メゾ複雑体)が細胞内に存在しており、生理的に重要な役割を担っていることが報告された。
本研究では、代表的なメゾ複雑体の1つである細胞内LLPS液滴の生物物理学的性質を解明するために新規超解像顕微鏡の開発を行う。本研究計画で開発する新規超解像顕微鏡は「細胞内・1分子・3次元・高速・高精度・長時間」という特徴を併せ持つ顕微鏡である。通常、顕微鏡において上記の性能はトレードオフの関係にあり並立させることは難しいが、本顕微鏡は「蛍光色素を光らせずに検出する」という新しいコンセプトに基づいた顕微鏡であるため、既存の1分子顕微鏡に比べて高い次元で上記の性能を実現させることが可能である。そして、この新規超解像顕微鏡を用いて細胞内LLPS液滴を構成する生体分子の分子構造動態を1分子粒度で計測することを目指す。さらに、この技術を多くの生物学研究者が利用しやすいように全自動計測プラットフォームの構築も合わせて行う予定である。
7月末に開催された第2回領域会議ではA02班(生物課題班)の研究者の方々との初顔合わせを通して、最先端のクロススケール生物学研究における計測上の課題についてより理解を深めることができた。Cryo-ETなどの高解像度撮影技術で計測されているメゾ複雑体に注目し、細胞内での動態計測を行うための装置開発を引き続き行っていく。また、装置開発に平行して実際の計測に向けて注目するメゾ複雑体の計測試料系の構築準備も進めていく。
メゾ複雑体が構築する脂質輸送場のクロススケール解析
研究代表者:的場 一晃(微生物化学研究所 構造生物学研究部・主任研究員)
研究内容
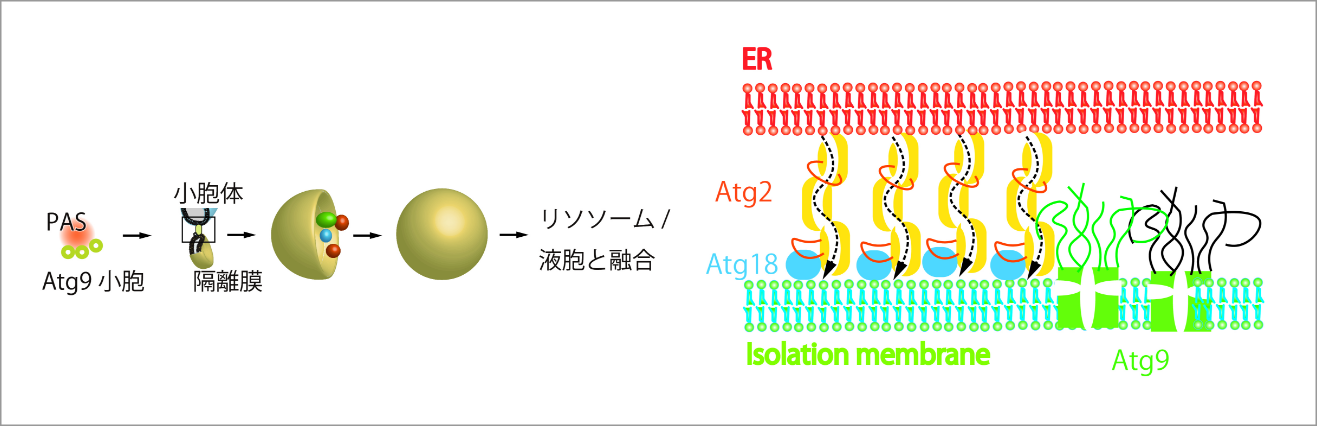
当研究班の目的は、脂質輸送に関わるタンパク質群の多数集まった複雑体が、細胞内でまさに機能する際の実体や作動機構を様々な手法で解析することで、オルガネラ間の脂質輸送の基本原理の解明することです。隣接するオルガネラ同士の接触部位(Membrane contact site :MCS)は、一過的に相互作用を起こす場であり、シグナル分子や脂質、アミノ酸、金属、各種イオンなどがMCSを介して輸送されます。MCSの膜間の距離は一般的に10–30 nmで、タンパク質-タンパク質、タンパク質-脂質の相互作用により一時的に維持されます。MCSでの脂質輸送は様々なオルガネラ間で見られますが、オートファジーでは小胞体と隔離膜の間で脂質輸送が行われます。オートファジーの脂質輸送場は様々なタンパク質が集まり、106の脂質分子を10分程度で小胞体から隔離膜へ輸送すると考えられています。酵母ではAtg2、Atg9がMCSに局在し、それぞれが脂質輸送、脂質スクランブルを行っていると考えられるが、これらの因子群が、複雑体を形成することで脂質の大量高速輸送を可能にしていると仮説を立て、複雑体の分子間相互作用や動的挙動、構造を様々な手法で解析し、複雑体の実体を解明します。
本研究によりMCSでの脂質輸送機構に関する基本原理が明らかとなることで、オートファジー分野に限らず様々なオルガネラ間での脂質輸送機構に関する知見が得られることが期待されます。そして個々のタンパク質が単独ではなく、それらが複雑体を形成することが大量高速脂質輸送の作動に関わっているか明らかにしたい。
クロススケール顕微鏡の開発
研究代表者:藤芳 暁(東京工業大学理学院物理学系・助教)
研究内容
本領域の推進する「クロススケール新生物学」において、我々のグループは、細胞内にあるメゾ複雑体を分子レベルで可視化し、生命の謎に挑むために、「クロススケール顕微鏡」を開発する。このクロススケール顕微鏡とは、クライオ電子顕微鏡とクライオ蛍光顕微鏡を組み合わせたナノレベルの分解能の顕微鏡のことであり、Correlative light electron microscopy(CLEM)のナノレベル版と言える。
蛍光顕微鏡は、細胞全体を分子選択的にイメージングすることはもちろん、リン酸化などの化学修飾選択的イメージングも可能であるが、分子レベルの分解能はない。一方、クライオ電子顕微鏡は、細胞全体を観察することはできないが、厚さ100 nmに切片化された細胞ならば分子レベルに近い分解能でイメージングできる。このように、2つの顕微鏡は得意とする観察対象が異なっており、二つを組み合わせることができればとても強力な方法になるはずである。しかし、実際には、蛍光顕微鏡の分解能が電子顕微鏡に比べて2桁悪いために、同一視野を観察しても、それぞれの情報を相関させることが困難である。ごく最近、我々はクライオ蛍光顕微鏡の分解能をナノメーターにすることに成功しており、光と電子との分解能の隔たりを解消した。下図に、我々が開発した技術の一部をしめす。
本課題では、独自開発したクライオ蛍光顕微鏡とクライオ電子顕微鏡とを組み合わせた「クロススケール顕微鏡」を開発することを目指す。特に、当該課題では、試料共有のための技術を重点的に開発する予定である。これにより、細胞内のメゾ複雑体を観察し、生命現象の謎に挑む。