仁田亮計画研究代表と丹羽伸介公募研究代表との領域内共同研究の二つの成果が、いずれもELife誌に掲載されました
- CAMSAP2 organizes a γ-tubulin-independent microtubule nucleation centre through phase separation
Imasaki T, Kikkawa S, *Niwa S, ..., Takeichi M, *Nitta R
eLife, 11:e77365. doi: 10.7554/eLife.77365 (2022) - Structural model of microtubule dynamics inhibition by Kinesin-4 from the crystal structure of KLP-12 – tubulin complex
Taguchi S, Nakano J, Imasaki T, ..., Mizobuchi S, *Niwa S, *Nitta R
eLife, 11:e77877. doi.org/10.7554/eLife.77877 (2022)
生体内の細胞は、それぞれの機能を果たすために最適な細胞の形をしています。例えば神経細胞は長い突起を作って体中の様々な情報を伝達するために適した形を作りますし、消化管上皮細胞は、消化管内腔から取り込んだ物質を血管やリンパ管などに送るために、頂端側から基底側へ規則正しく細胞内物質輸送のレール(細胞骨格)や細胞内小器官を配置します。このような細胞の形の屋台骨となるのが直径25 nmの管状の重合体である微小管であり、微小管に作用する様々な微小管結合タンパク質群が、微小管の重合の開始、配列や長さをコントロールしています。
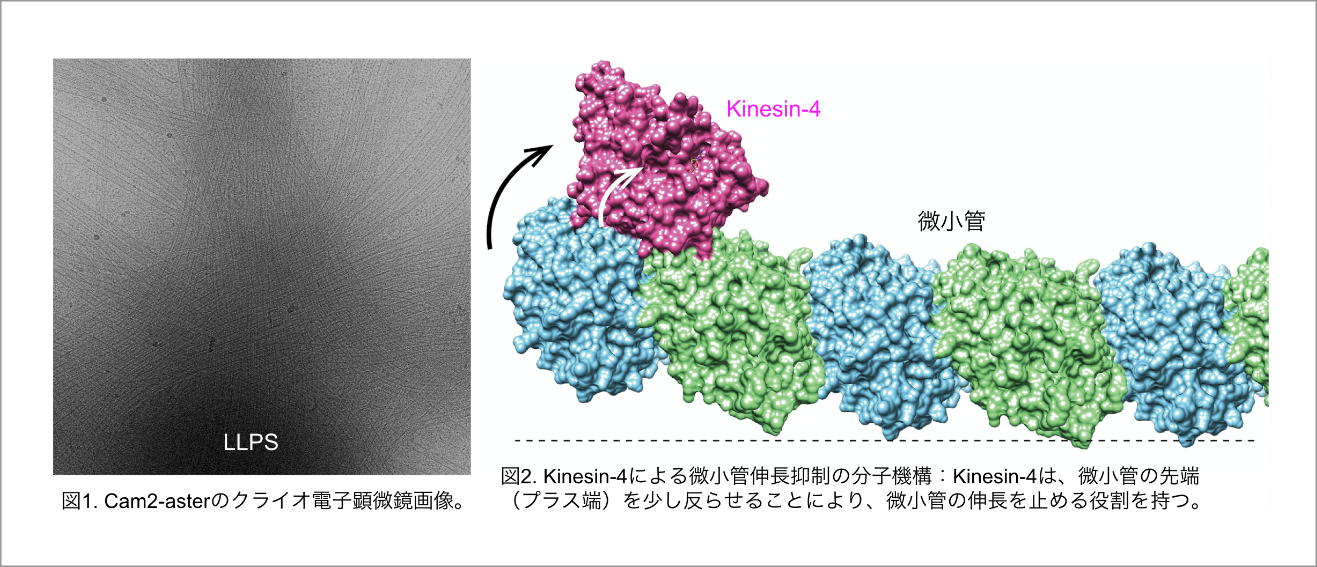
仁田、丹羽らの研究グループは、CAMSAP2という微小管結合タンパク質が、神経細胞や消化管上皮細胞など、極性のある細胞の中で微小管の重合が始まる起点=形成中心(MTOC)になることを発見しました(論文1)。CAMSAP2タンパク質は、液-液相分離(LLPS)を形成してその中に微小管の材料Tubulinを取り込んで濃縮します。LLPS内部ではTubulinがまずリング状のオリゴマーを形成します。そしてリングが束になってシート状に伸び、次いでシートが管状に丸まって微小管となり、LLPSから放射状にたくさんの微小管が萌出していきます。我々は、この構造が中心体で形成される星状体と酷似しているため「Cam2-aster」と名付けました(図1)。今後は、クロススケール計測技術を用い、Cam2-asterの形成の現場を高速分子動画として捉え、さらにはMTOCとして働くCAMSAP2のLLPSの細胞内での局在を制御することによる細胞極性形成の分子機構を解明していきます。
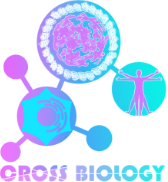
また、微小管上を動く分子モーターキネシンの一種であるKinesin-4モーターが、微小管の上を動くのみならず、微小管の伸長を止める役割を果たしていることを発見しました(論文2)。そして、Kinesin-4モーターが微小管伸長端に結合する場面を高分解能構造として捉え、微小管の端をやや反らせることによって微小管の伸長を阻害していることを明らかにしました(図2)。Kinesin-4は、染色体の配列や神経細胞軸索の長さを精巧に調節しており、その異常は神経変性疾患などの原因ともなる重要な分子です。本研究成果は、新たな治療戦略を開発するための出発点になります。